-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

摩熵咨询医药行业观察周报(2025.03.31-2025.04.06)
1.1总体概况
根据摩熵医药数据库统计,2025.03.31-2025.04.06期间共有38个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号27个,进口药品受理号11个。
本周共计43款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药18款,生物药25款,无中药。其中值得注意的有:
(1)HRS-6719片
3月31日,CDE官网公示:恒瑞医药的HRS-6719片获得临床试验默示许可,用于治疗甲硫腺苷磷酸化酶(MTAP)缺失的实体瘤。公开资料显示,HRS-6719片是一种新型、高效、选择性的小分子抑制剂,通过“合成致死”效应选择性地抑制肿瘤细胞内mRNA剪接、DNA损伤修复等一系列基础生物学过程,从而发挥抗肿瘤作用。
(2)IMP-1707片
3月31日,CDE官网公示:英派药业的IMP-1707片获得临床试验默示许可,用于治疗晚期实体瘤。公开资料显示,IMP-1707片是英派药业与Eikon Therapeutics合作开发的产品之一(又称EIK1004),为一种可进入中枢神经系统的PARP1选择性抑制剂,可有效地选择性抑制和捕获PARP1,并具有下游活性,其还具有脑渗透和较高的生物利用度。
(3)HBW-012336胶囊
4月1日,CDE官网公示:海博为药业的HBW-012336胶囊获得临床试验默示许可,用于治疗携带KRAS G12D突变的局部晚期或转移性实体瘤。公开资料显示,HBW-012336胶囊是一款口服KRAS G12D抑制剂,该药不仅解决了G12D抑制剂口服生物利用度低的国际性难题,还具有高活性、高选择性、高组织靶向性及强效抗肿瘤活性等突出优势。
本周共5款新药获批上市,即艾考磷布韦片、玛舒拉沙韦片、奥瑞利珠单抗注射液、罗泽利昔珠单抗注射液和他氟噻吗滴眼液。
本报告涉及: 相关药物:HRS-1167片, 相关靶点:PARP1, 相关适应症:转移性前列腺癌 。
中心思想
本报告基于摩熵咨询医药行业观察周报(2025.03.31-2025.04.06)的数据,对国内外医药市场创新药、仿制药及相关政策法规进行分析。核心观点如下:
- 创新药研发活跃: 国内外创新药研发进展迅速,多个靶点药物获批临床或上市,涵盖肿瘤、神经系统疾病、代谢性疾病等多个领域,展现出强大的研发实力和市场潜力。
- 仿制药市场竞争激烈: 国内仿制药市场竞争日益激烈,一致性评价进程加快,部分品种过评/视同过评企业数量众多,显示出市场份额的争夺态势。
- 政策法规持续完善: 国家持续出台相关政策法规,旨在优化医药行业监管,支持创新发展,规范市场秩序,推动医药大健康产业高质量发展。
主要内容
国内创新药/改良型新药市场分析
本周(2025.03.31-2025.04.06)共有38个创新药/改良型新药临床申请/上市申请获CDE承办,其中国产药品27个,进口药品11个。43款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药18款,生物药25款。5款新药获批上市,涵盖抗病毒、抗流感、多发性硬化症、重症肌无力、青光眼等治疗领域。
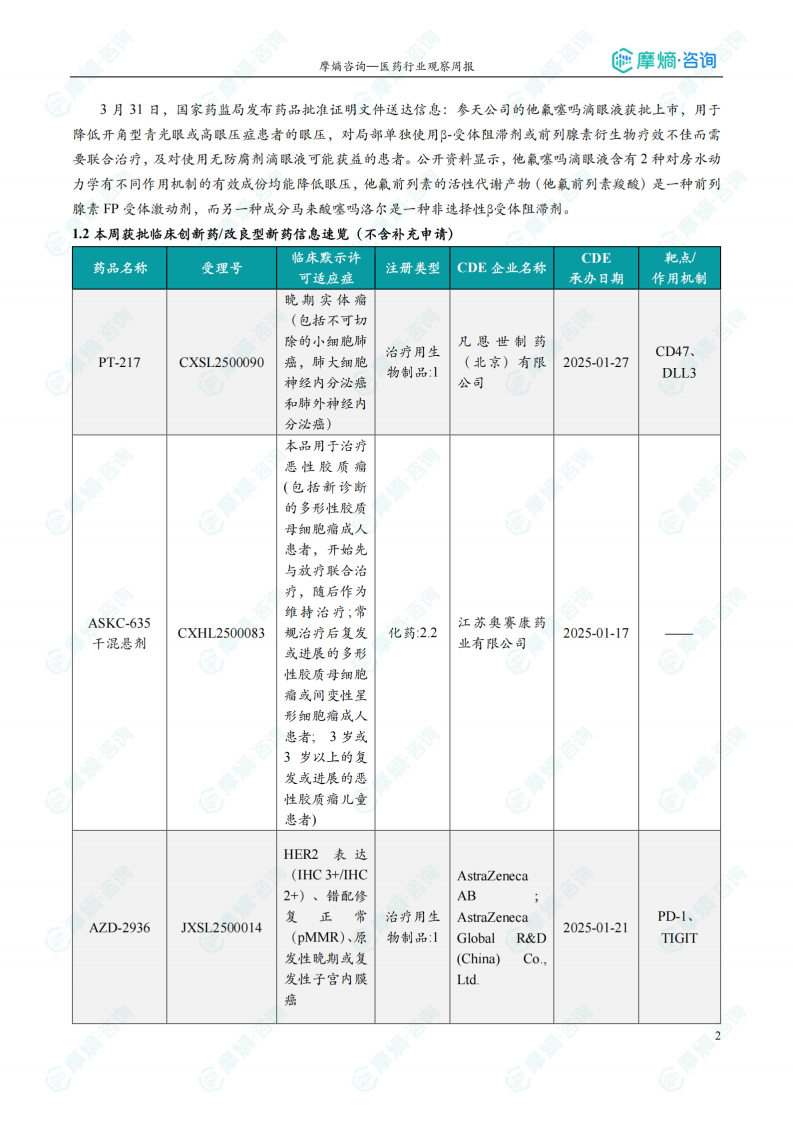
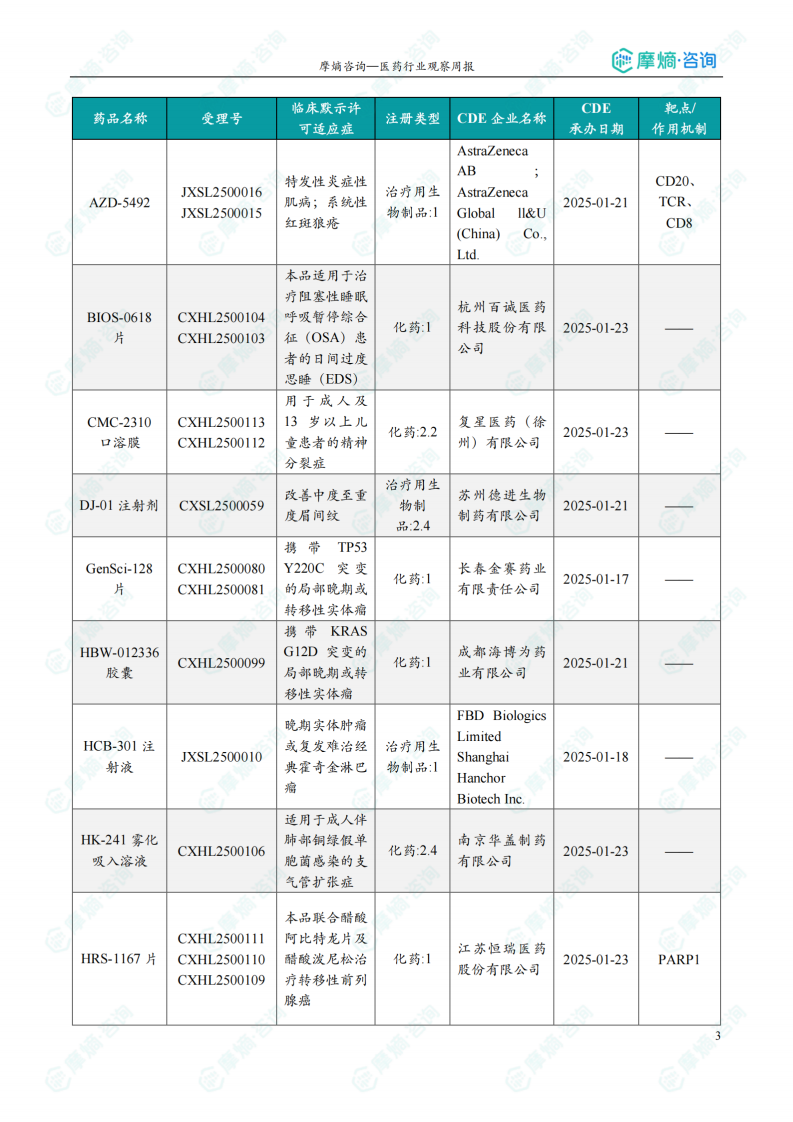
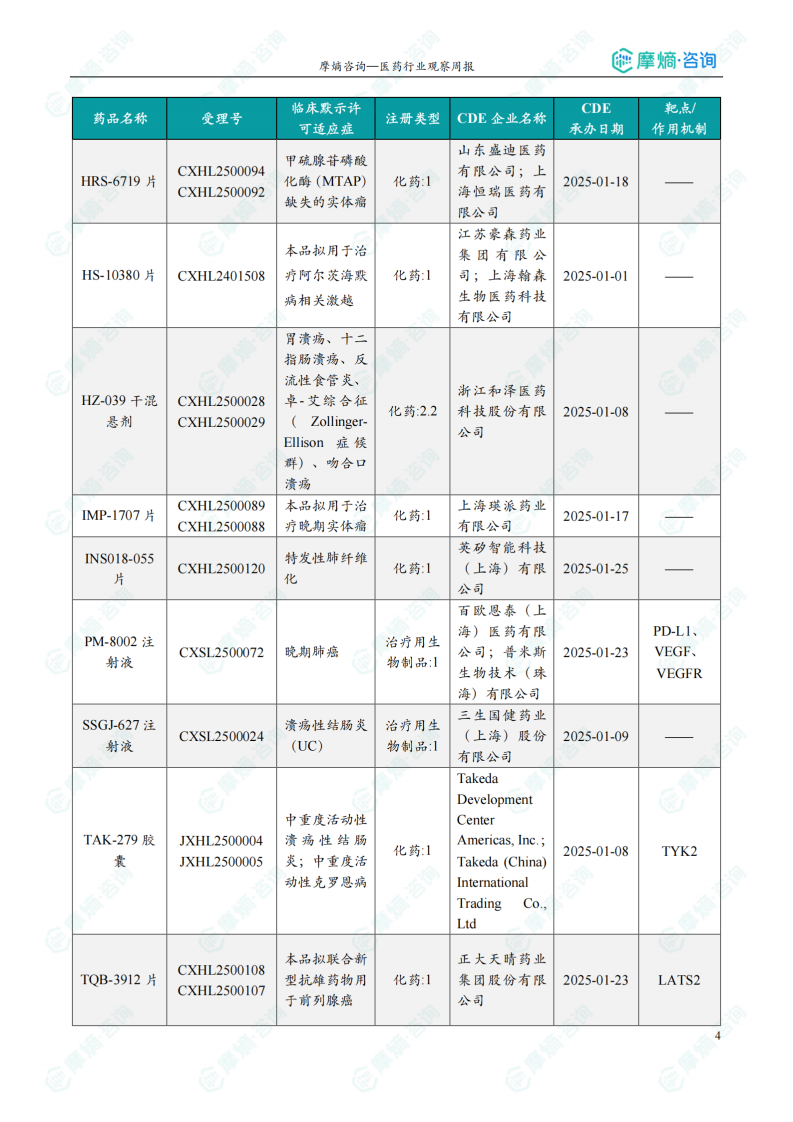
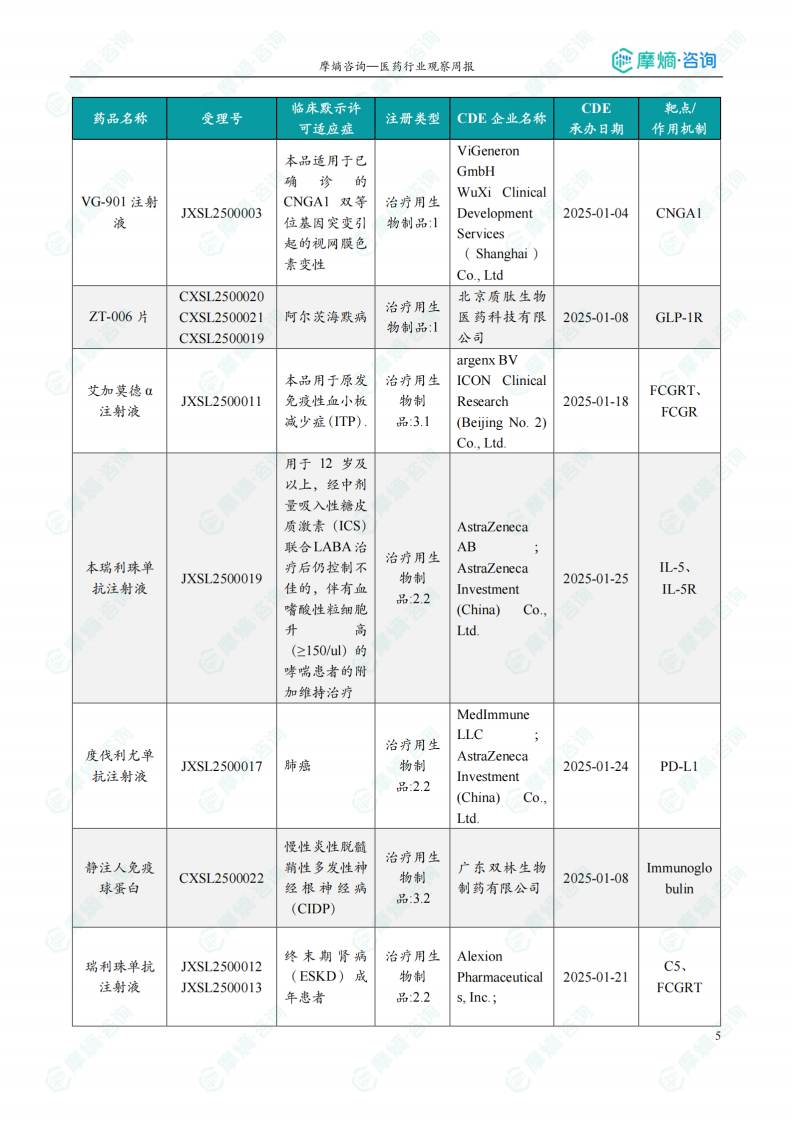
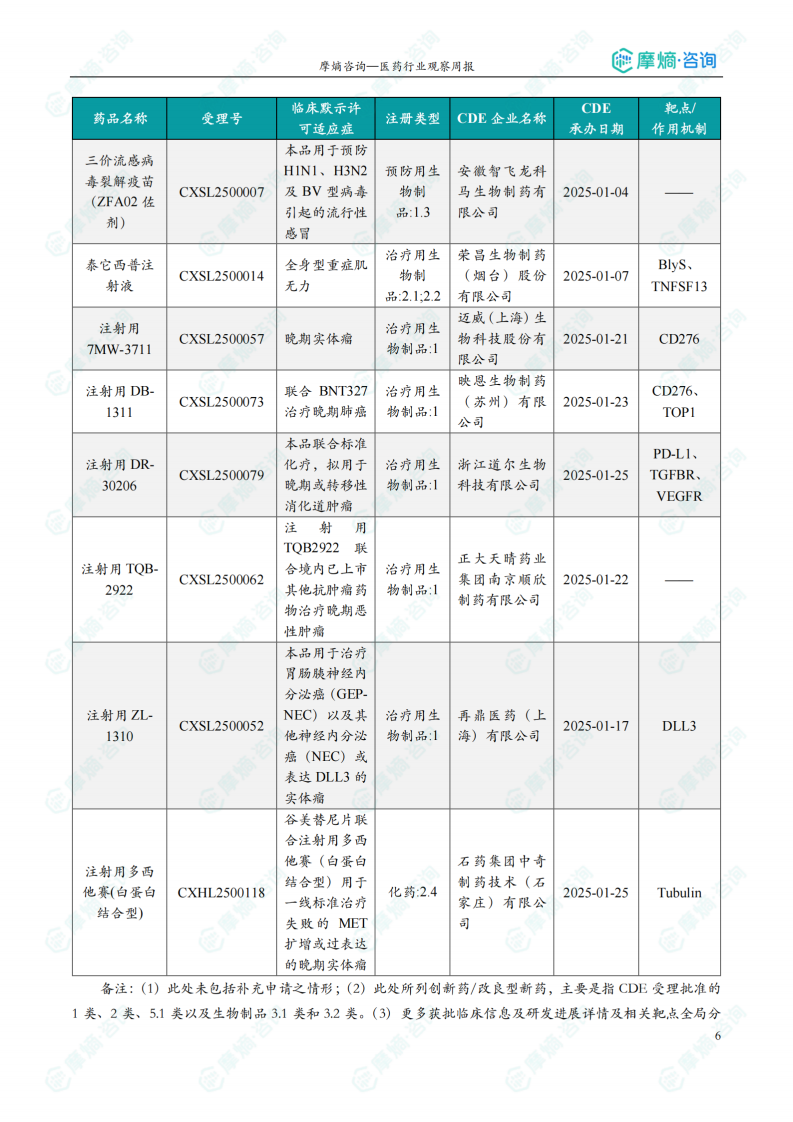
获批临床创新药信息速览
数据显示,本周获批临床的创新药涵盖多个靶点和适应症,例如:靶向CD47、PD-1、TIGIT、KRAS G12D、PARP1等,治疗适应症包括晚期实体瘤、恶性胶质瘤、子宫内膜癌、阿尔茨海默病等。值得关注的是恒瑞医药的HRS-6719片(靶向MTAP缺失实体瘤)、英派药业的IMP-1707片(靶向PARP1晚期实体瘤)、海博为药业的HBW-012336胶囊(靶向KRAS G12D突变实体瘤)等创新药物。这些药物的获批,标志着国内创新药研发在多个领域取得了显著进展。
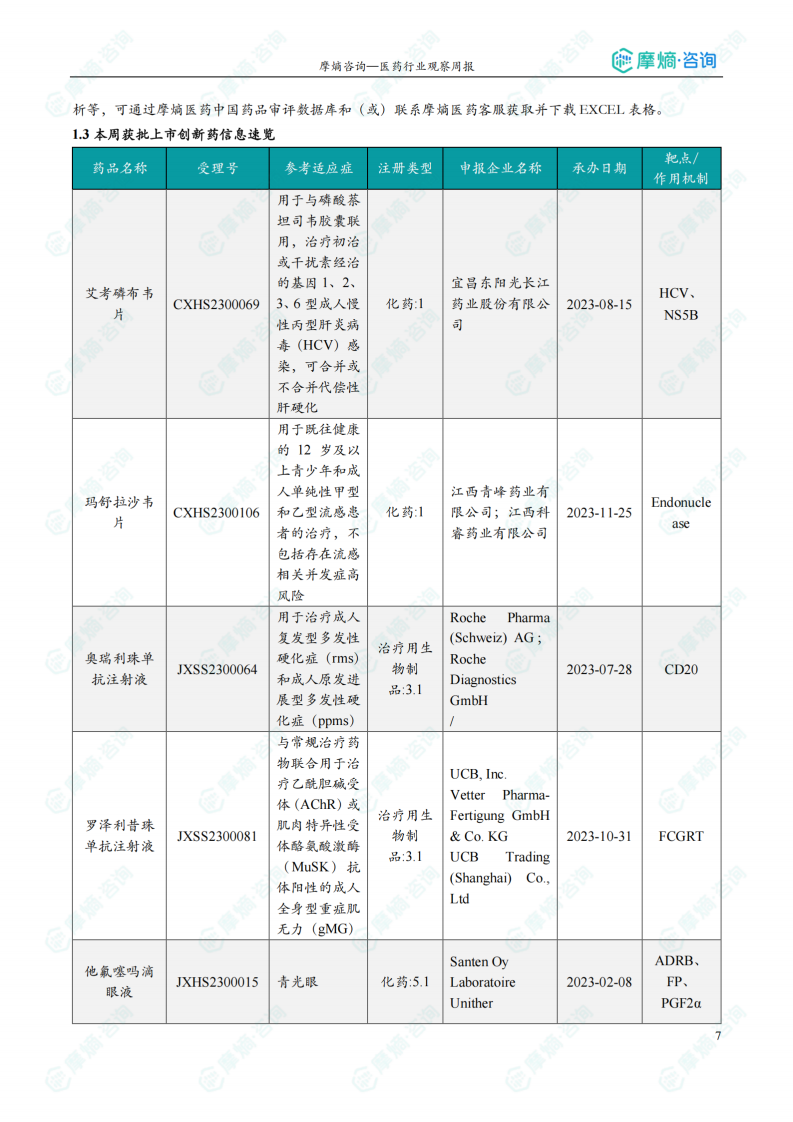
获批上市创新药信息速览
本周获批上市的创新药包括艾考磷布韦片(丙肝)、玛舒拉沙韦片(流感)、奥瑞利珠单抗注射液(多发性硬化症)、罗泽利昔珠单抗注射液(重症肌无力)、他氟噻吗滴眼液(青光眼)等。这些药物的上市,将为患者提供更多有效的治疗选择,并推动相关疾病治疗水平的提升。
国内仿制药/生物类似物市场分析
本周共有72项仿制药申报上市/申报临床获CDE承办,其中一致性评价申请3项。5个品种通过一致性评价,54个品种视同通过一致性评价。本周有5项生物类似物注册申报动态。
一致性评价进展
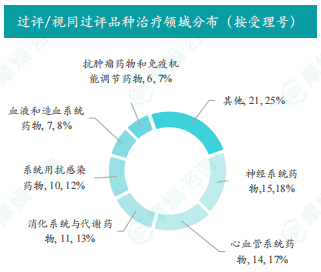
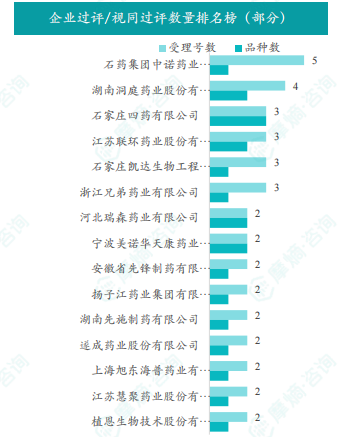
本周过评/视同过评品种主要为神经系统药物,剂型主要为注射剂。注射用头孢哌酮钠舒巴坦钠过评/视同过评受理号数量最多,福多司坦口服溶液、米诺地尔搽剂和氯化钾注射液过评/视同过评企业最多。石家庄四药有限公司过评/视同过评品种数最多。数据显示,仿制药市场竞争激烈,部分品种过评/视同过评企业数量众多。
首次过评/视同过评品种及过评/视同过评达7家品种盘点
报告详细列举了本周首次过评/视同过评品种和过评/视同过评达7家企业的品种,提供了药品名称、受理号、申报企业、适应症等信息,方便读者了解市场动态。
国内医药大健康行业政策法规分析
本周重点关注两项政策法规:《体外诊断试剂稳定性研究注册审查指导原则》和《关于优化全生命周期监管支持高端医疗器械创新发展的举措》。前者旨在加强医疗器械注册申报和技术审评指导,后者旨在完善审评审批机制,加强全生命周期监管,支持高端医疗器械创新发展。
全球创新药研发概览
本报告总结了本周全球TOP10创新药研发进展和TOP10积极/失败临床结果。
创新药研发进展
多个创新药获批上市或进入临床试验阶段,涵盖CAR-T疗法、小分子抑制剂、单克隆抗体、siRNA疗法等多种技术路线,治疗适应症涵盖肿瘤、血液病、代谢性疾病等多个领域。例如,永泰生物的爱可仑赛注射液上市申请获NMPA受理,安进的Uplizna获FDA批准用于治疗IgG4相关疾病,赛诺菲的Fitusiran获FDA批准用于血友病A/B预防治疗等。
积极/失败临床结果
报告总结了多个创新药的临床试验结果,包括默沙东的Winrevair在肺动脉高压3期临床中显著降低风险,礼来的lepodisiran在脂蛋白代谢障碍2期临床中大幅降低Lp(a)水平,阿斯利康的AZD0780在降低LDL-C 2b期临床中展现显著疗效等积极结果,也提及部分临床试验结果未达到预期。
总结
本报告基于摩熵咨询医药行业观察周报的数据,对国内外医药市场创新药、仿制药及相关政策法规进行了全面的分析。数据显示,创新药研发持续活跃,仿制药市场竞争激烈,政策法规不断完善,推动医药大健康产业高质量发展。 报告中详细的数据和分析,为医药行业从业者提供了重要的市场参考信息。 未来,持续关注创新药研发进展、仿制药一致性评价进程以及政策法规变化,将对把握市场趋势,制定发展战略具有重要意义。
-

摩熵咨询医药行业观察周报(2026.01.26-2026.02.01)
-

2026年1月仿制药月报
-

2026年1月全球在研新药月报
-

摩熵咨询医药行业观察周报(2026.01.19-2026.01.25)
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 医药日报:阿斯利康Datroway获FDA优先审评资格
- 基础化工行业周报:原油、涤纶长丝价格上涨,关注地缘局势
- 医疗卫生行业:新冠肺炎全球风险评估-第9版
- 医药日报:诺华司库奇尤单抗新适应症在华获批
- 医药生物行业周报:诺华siRNA降脂药物在华获批新适应症,关注PCSK9及小核酸赛道
- 农化行业:2026年1月月度观察:钾肥合同价上涨,储能拉动磷矿需求,草铵膦将取消出口退税
- 医药日报:Lirafugratinib向FDA递交NDA
- 2025年中国生物创新药市场跟踪报告:司美格鲁肽2025年第一季度市场回顾
- 医药产业研究第9期:AlphaGenome首次揭开基因“暗物质”;中美创新药,监管比拼“全球首发”
- 医药生物行业周报:多家公司业绩预喜,创新药进入盈利兑现期
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送