-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

摩熵咨询医药行业观察周报(2025.12.29-2026.01.04)
摩熵咨询医药行业观察周报(2025.12.29-2026.01.04)
-
下载次数:
2891 次
-
发布机构:
摩熵咨询了解机构实力
-
发布日期:
2026-01-04
-
页数:
19页
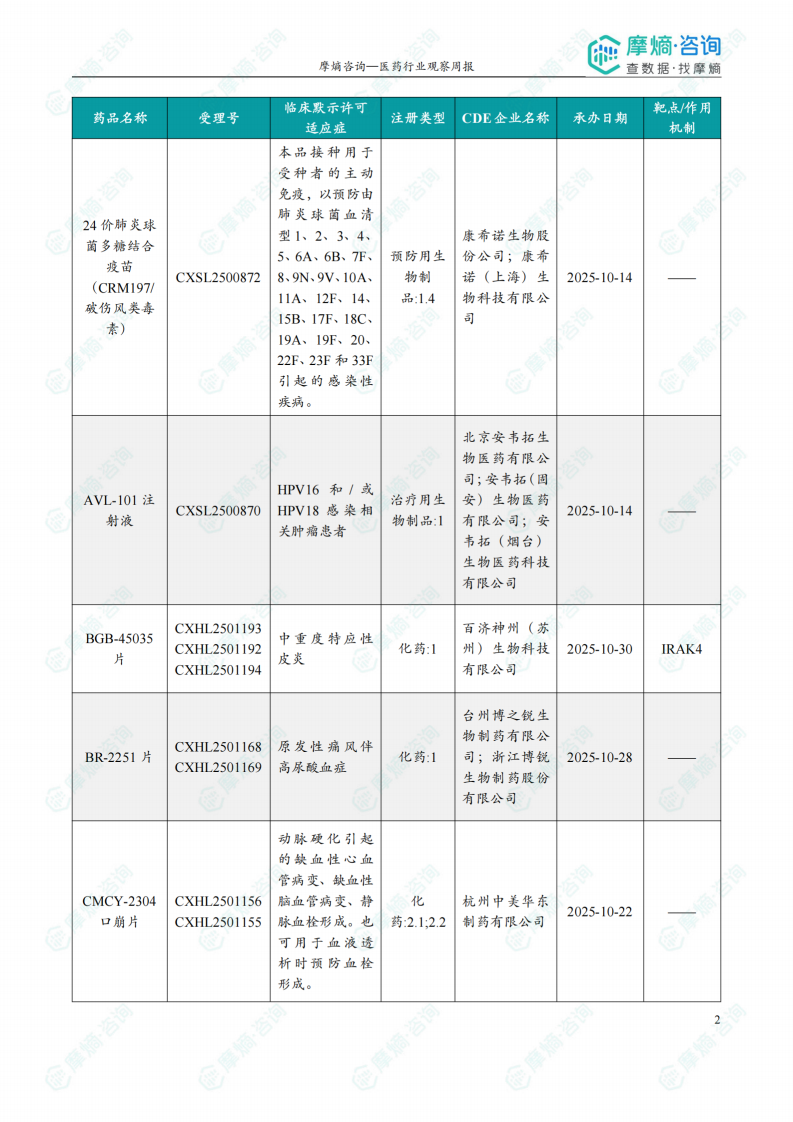
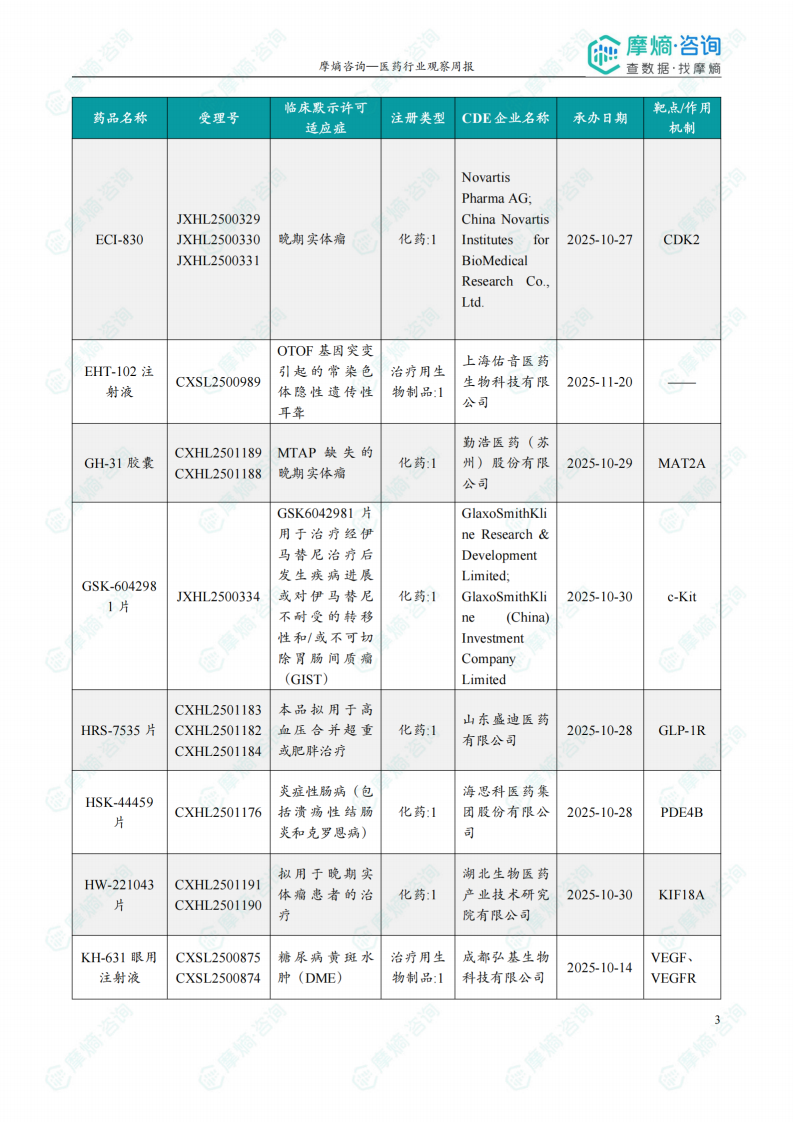
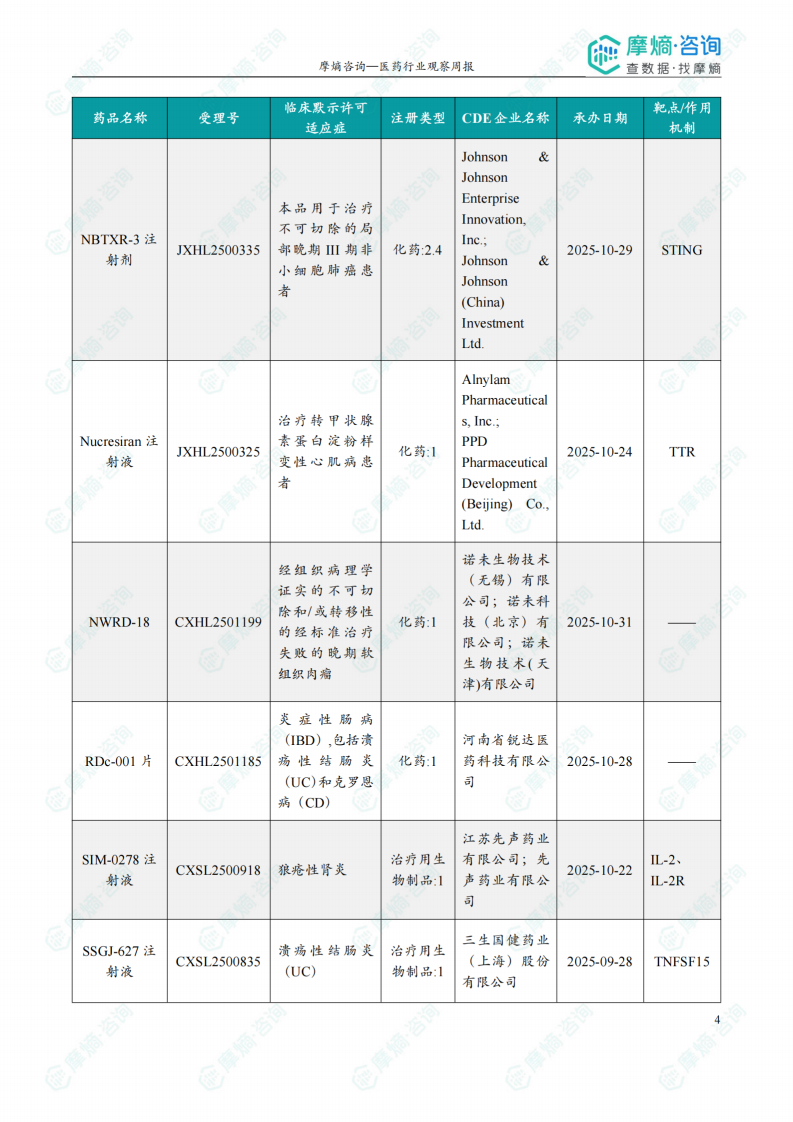
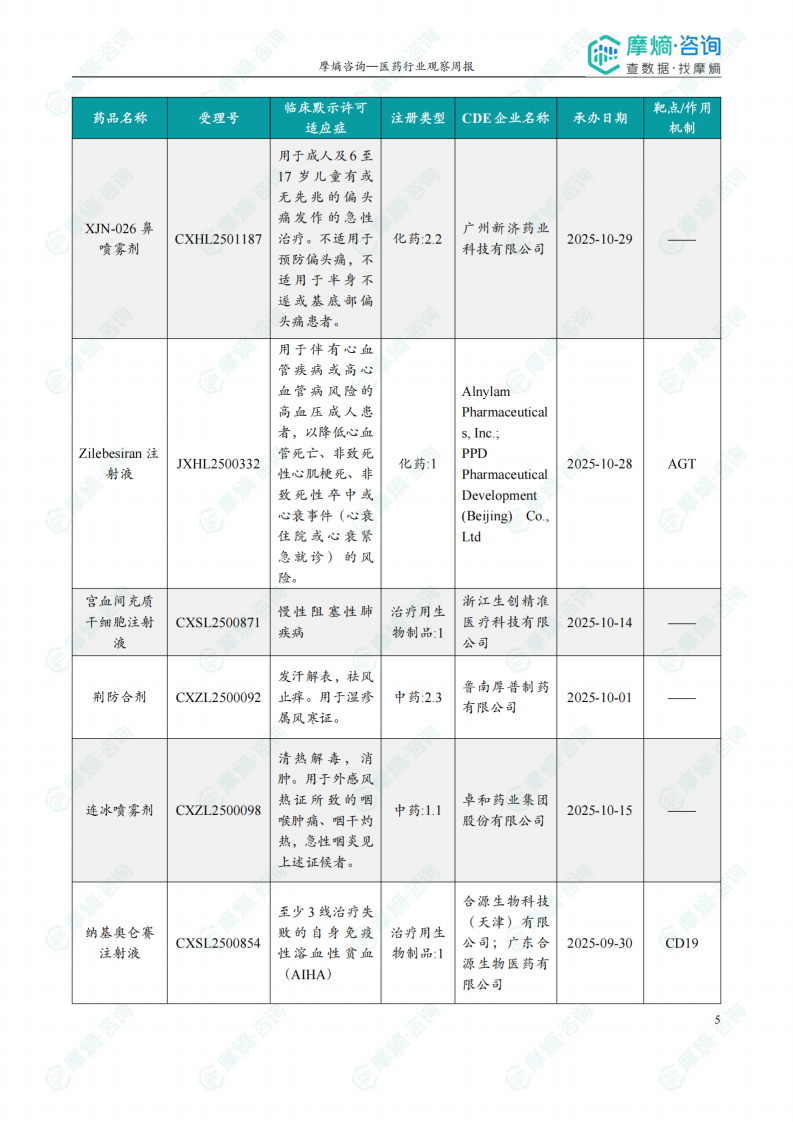
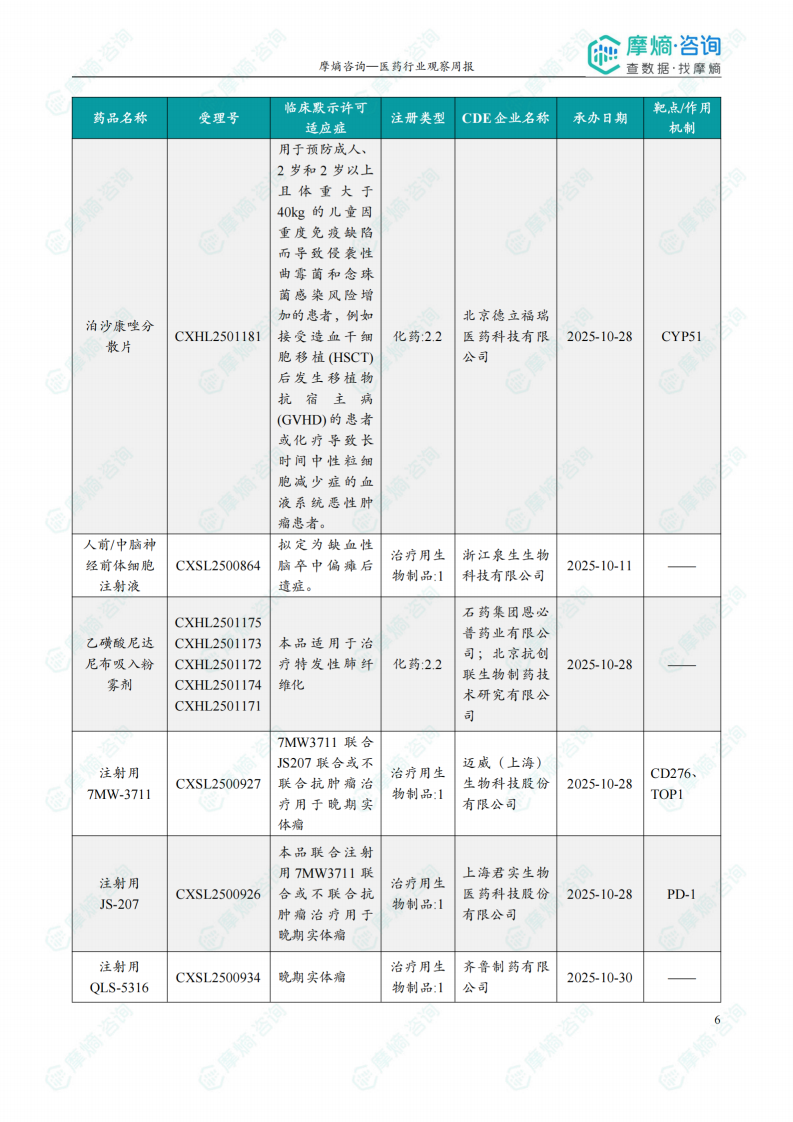
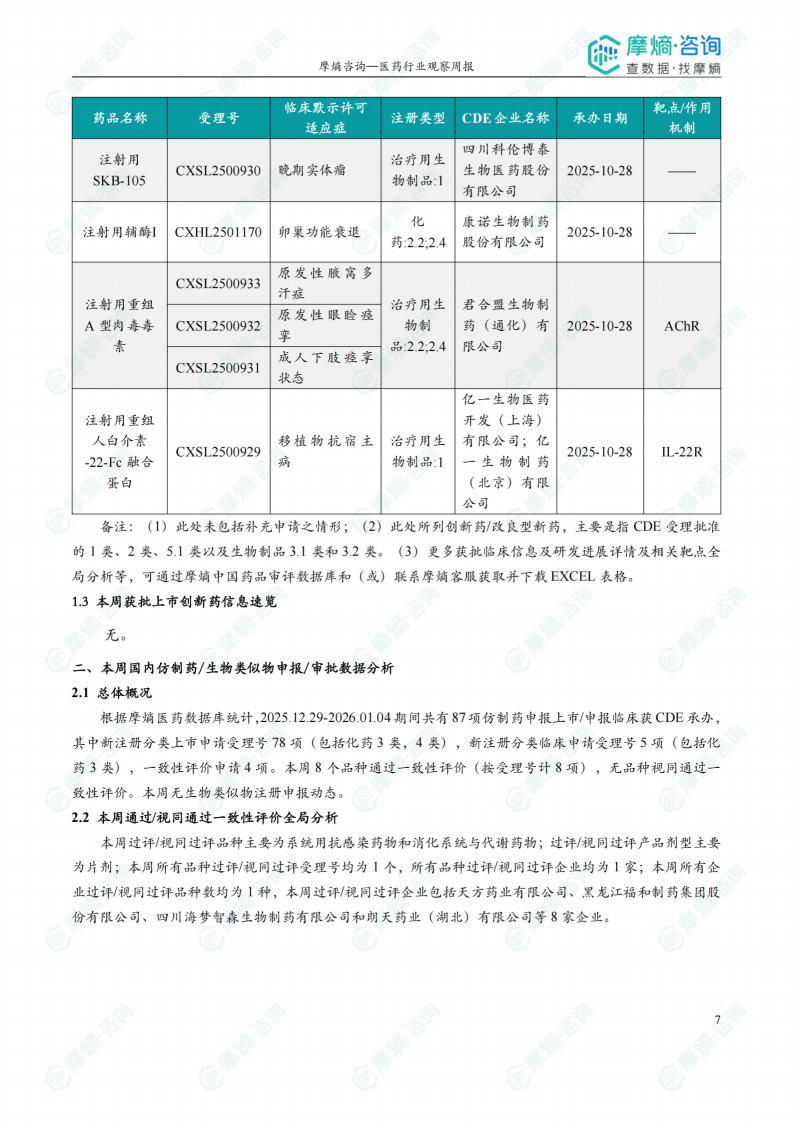
根据摩熵医药数据库统计,2025.12.29-2026.01.04期间共有116个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号100个,进口药品受理号16个。
本周共计44款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药23款,生物药19款,2款中药。其中值得注意的有:
(1)Nucresiran注射液和Zilebesiran注射液
12月30日和31日,CDE官网公示:Alnylam Pharmaceuticals申报的Nucresiran注射液和Zilebesiran注射液均获得临床试验默示许可,分别用于治疗转甲状腺素蛋白淀粉样变性心肌病患者和用于伴有心血管疾病或高心血管病风险的高血压成人患者,以降低心血管死亡、非致死性心肌梗死、非致死性卒中或心衰事件(心衰住院或心衰紧急就诊)的风险。公开资料显示,Nucresiran是一种在研RNAi疗法,通过Alnylam专有IKARIA平台所开发,旨在迅速降低突变型和野生型转甲状腺素蛋白(TTR)的水平,从根本上治疗转甲状腺素蛋白(ATTR)淀粉样变性。Zilebesiran通过皮下注射抑制肝脏中血管紧张素原(AGT)的表达,仅需每半年给药一次,便可实现持续降压,并有望降低重大心血管事件风险。
(2)注射用SKB-105
2026年1月4日,CDE官网公示:科伦博泰的注射用SKB-105获得临床试验默示许可,拟用于治疗晚期实体瘤。公开资料显示,SKB-105是一款靶向整合素β6(ITGB6)的抗体偶联药物(ADC)。SKB105由靶向ITGB6的全人源IgG1单抗与稳定且经临床验证的可裂解连接子偶联,采用Kthiol不可逆偶联技术,旨在增强药物稳定性及肿瘤特异性载荷递送能力,同时减少不良反应。
(3)GH-31胶囊
2026年1月4日,CDE官网公示:锐达医药申报的GH-31胶囊获得临床试验默示许可,拟用于MTAP缺失的晚期实体瘤。公开资料显示,GH31是基于结构生物学、人工智能(AI)等方法设计并合成的一款高效、安全的小分子候选药物。日前,该药的IND申请也已获得FDA批准。
本报告涉及: 相关药物:SIM-0278注射液, 相关靶点:IL-2、IL-2R, 相关适应症:狼疮性肾炎 。


-

摩熵咨询医药行业观察周报(2026.02.02-2026.02.08)
-

摩熵咨询医药行业观察周报(2026.01.26-2026.02.01)
-

2026年1月仿制药月报
-

2026年1月全球在研新药月报
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送