-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

摩熵咨询医药行业观察周报(2025.02.03-2025.02.09)
根据摩熵数据统计,2025.02.03-2025.02.09期间共有84个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号70个,进口药品受理号14个。
本周共计58款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药27款,生物药31款,无中药。其中值得注意的有:
(1)AA-001单抗
2月5日,CDE官网公示:智源鸿晟生物的AA-001单抗获得临床试验默示许可,用于晚期恶性肿瘤治疗。公开资料显示,AA-001单抗是基于采用无效应片段(Fc段)或无效应功能的β-淀粉样蛋白(Aβ)抗体策略开发的新一代AD治疗抗体候选药物。
(2)AWT-020注射用无菌粉末
2月5日,CDE官网公示:君实生物的AWT-020注射用无菌粉末获得临床试验默示许可,用于绝经后激素受体阳性的局部晚期或转移性乳腺癌患者的治疗。公开资料显示,AWT-020注射用无菌粉末是一种PD-1和IL-2双功能性抗体融合蛋白,通过阻断PD-1通路并选择性激活IL-2信号通路来增强抗肿瘤免疫反应。
(3)Eflapegrastim注射液
2月6日,CDE官网公示:韩美制药的Eflapegrastim注射液获得临床试验默示许可,针对接受细胞毒性化疗治疗实体瘤和恶性淋巴瘤患者,缩短其重度中性粒细胞减少症的持续时间。公开资料显示,Eflapegrastim注射液是一种人源IgG4单抗,也是一种粒细胞集落刺激因子(G-CSF)。Eflapegrastim靶向G-CSF受体(c-Fms)。Eflapegrastim刺激中性粒细胞祖细胞的增殖和分化,维持成熟和功能性中性粒细胞数目稳定。Eflapegrastim还缩短中性粒细胞减少的持续时间。
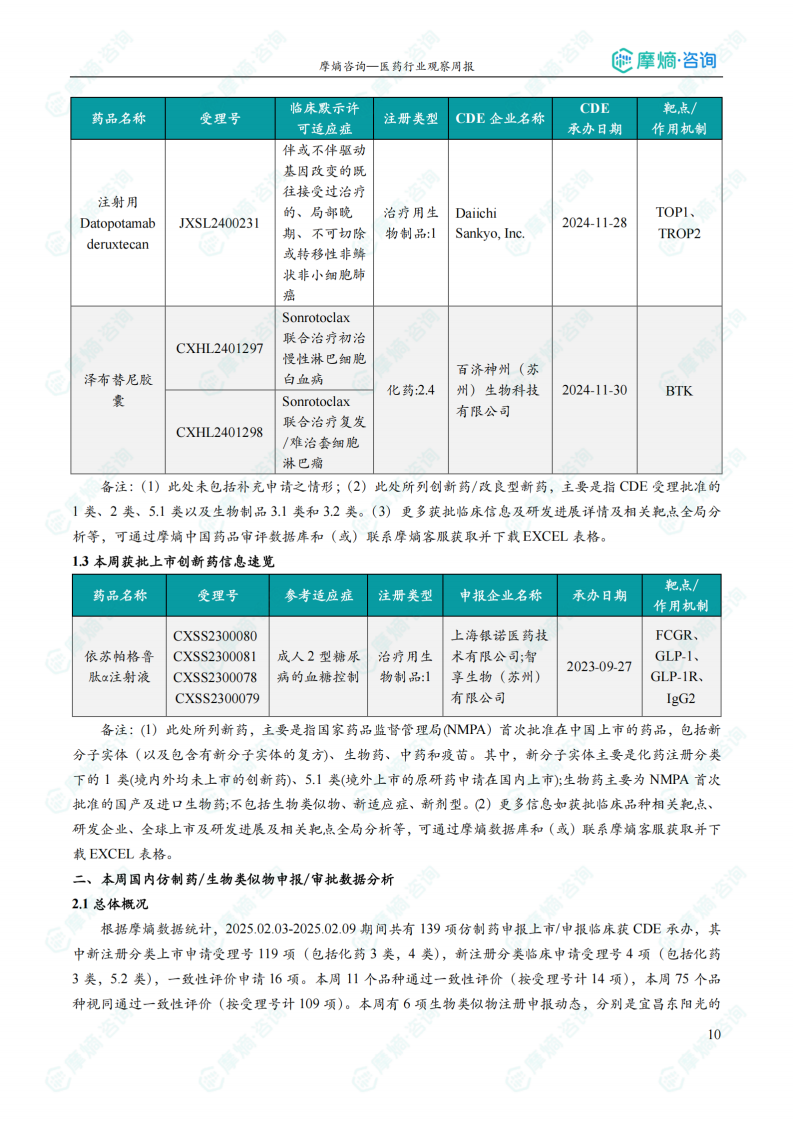
本周共1款新药获批上市,即依苏帕格鲁肽α注射液。
本报告涉及: 相关药物:adagrasib片, 相关靶点:KRAS, 相关适应症:非小细胞肺癌 。
中心思想
本报告基于摩熵咨询2025年2月3日至2025年2月9日医药行业观察周报数据,对中国及全球医药市场创新药、仿制药及生物类似物研发和审批动态进行统计分析,并对重点政策法规进行解读。核心观点如下:
国内创新药研发加速,获批临床数量显著
本周国内创新药/改良型新药研发活动活跃,共有84个品种获得CDE承办,其中默示许可58个,涵盖化学药和生物药,展现出国内创新药研发持续加速的趋势。值得关注的是多个靶向PD-1、IL-2等免疫检查点及其他重要靶点的创新药物获批临床,显示出免疫肿瘤治疗领域的持续火热。
仿制药一致性评价进展迅速,生物类似物申报活跃
国内仿制药一致性评价工作持续推进,本周共有11个品种通过一致性评价,75个品种视同通过,主要集中在心血管系统药物领域。同时,生物类似物申报也较为活跃,多个品种的申报动态值得关注,反映出仿制药市场竞争日益激烈,以及生物类似物市场发展潜力巨大。
政策法规持续完善,推动医药行业高质量发展
国家药监局发布了支持化妆品原料创新和修订甲磺酸吉米沙星片说明书的公告,体现了监管部门对医药大健康行业高质量发展的重视,以及对药品安全性和消费者权益的保障。
主要内容
国内创新药/改良型新药研发及审批情况分析
国内创新药总体概况及重点品种解读
本周共有84个创新药/改良型新药临床申请/上市申请获CDE承办,国产药品70个,进口药品14个。其中,58款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药27款,生物药31款。报告重点分析了智源鸿晟生物的AA-001单抗(靶向阿尔茨海默病)、君实生物的AWT-020注射用无菌粉末(PD-1和IL-2双功能性抗体融合蛋白)、韩美制药的Eflapegrastim注射液(粒细胞集落刺激因子)等重点品种的研发进展和临床适应症。此外,依苏帕格鲁肽α注射液获批上市,用于成人2型糖尿病患者的血糖控制。
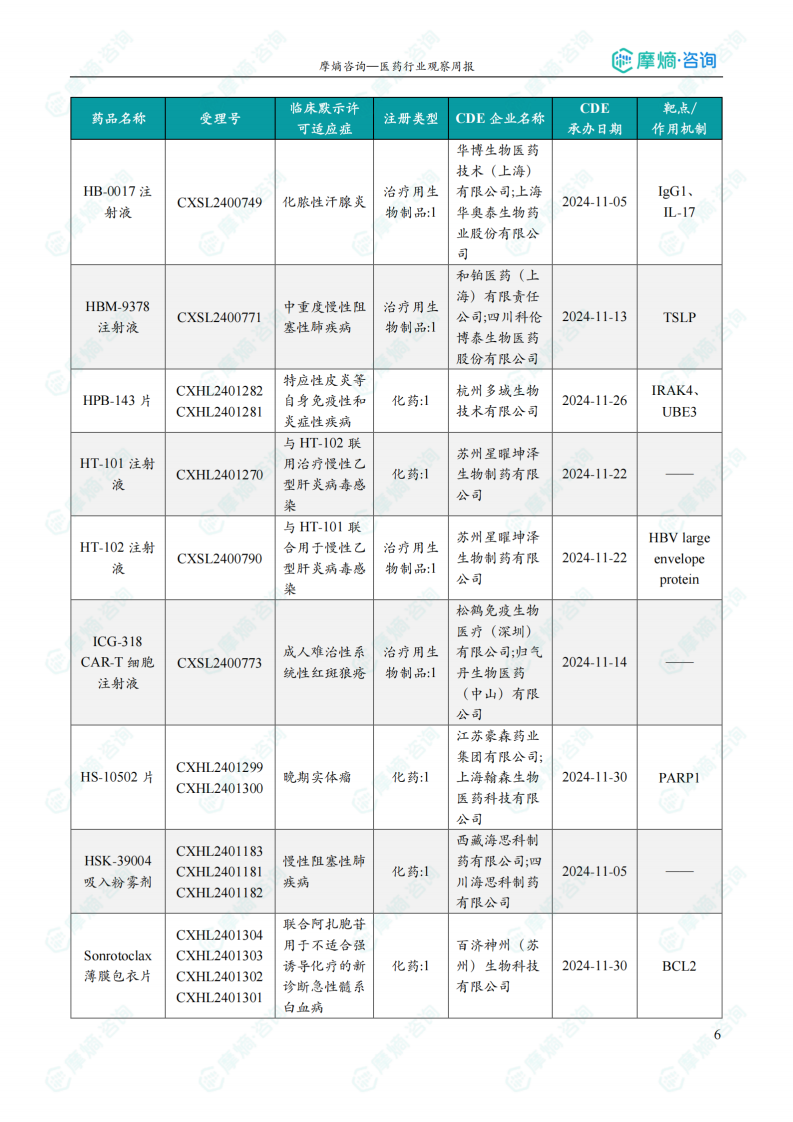
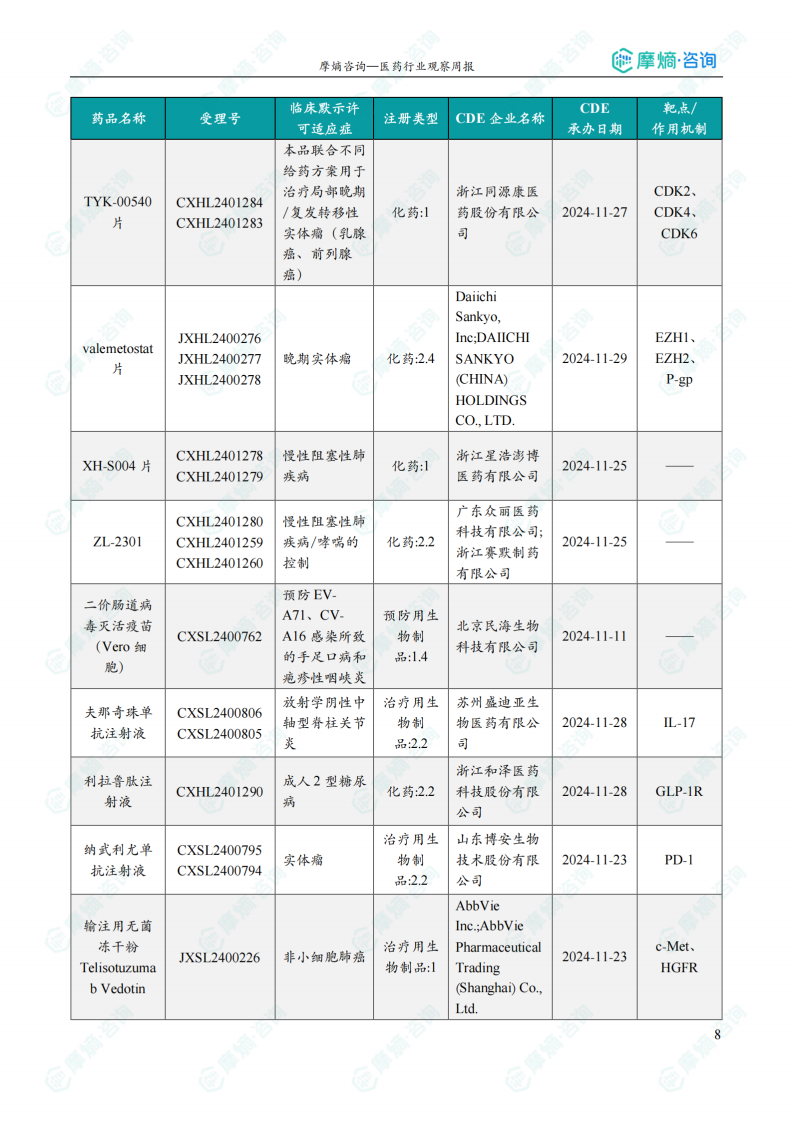
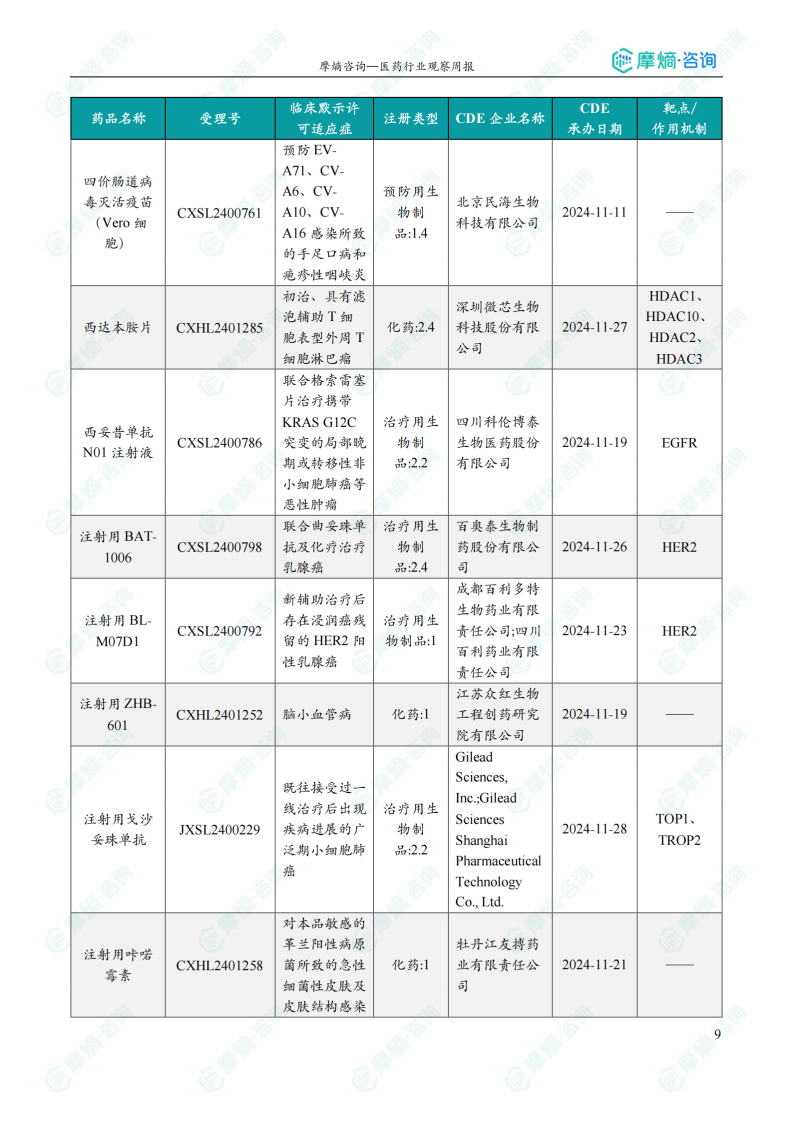
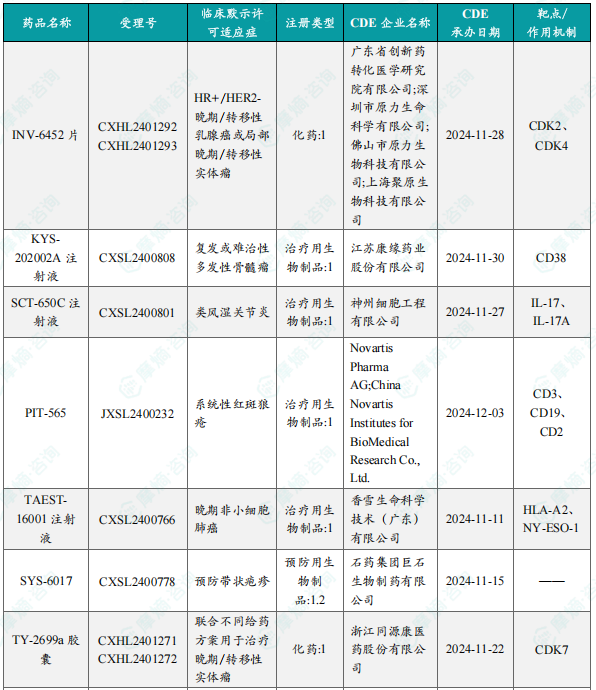
国内获批临床创新药/改良型新药信息速览
本部分详细列出了本周获批临床的创新药/改良型新药信息,包括药品名称、受理号、注册类型、CDE企业名称、可适应症、承办日期以及作用机制等关键信息。数据显示,获批临床的创新药涵盖多个治疗领域,靶点也较为多样化,反映出国内创新药研发领域的蓬勃发展。
国内获批上市创新药信息速览
本部分列出了本周获批上市的创新药信息,包括药品名称、受理号、参考适应症、注册类型、申报企业名称、承办日期以及作用机制等。数据显示,获批上市的创新药主要集中在糖尿病等治疗领域。
国内仿制药/生物类似物申报/审批情况分析
国内仿制药总体概况
本周共有139项仿制药申报上市/申报临床获CDE承办,其中新注册分类上市申请受理号119项,新注册分类临床申请受理号4项,一致性评价申请16项。本周11个品种通过一致性评价,75个品种视同通过一致性评价。
国内仿制药一致性评价全局分析
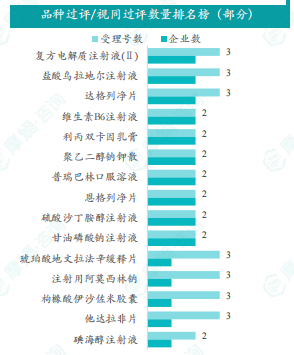
本部分对本周通过/视同通过一致性评价的品种进行了全局分析,包括治疗领域分布、剂型分布以及企业排名等。数据显示,过评/视同过评品种主要为心血管系统药物,剂型主要为注射剂。齐鲁制药有限公司、宜昌人福药业有限责任公司和杭州民生药业股份有限公司等企业过评/视同过评品种数量较多。
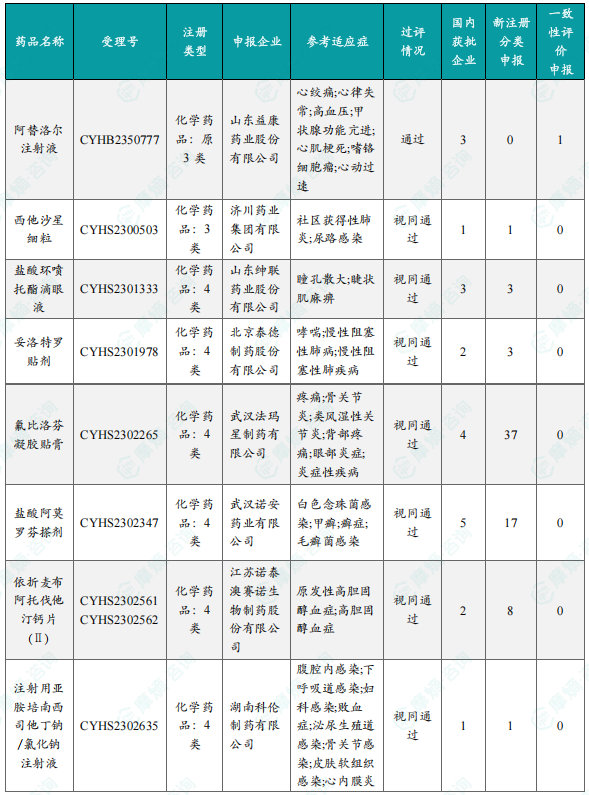
国内首次过评/视同过评品种及过评/视同过评达5家企业品种盘点
本部分分别列出了本周首次过评/视同过评的品种以及过评/视同过评达5家企业以上的品种,并提供了详细的药品信息,包括药品名称、受理号、申报企业、参考适应症、注册分类、类型、一致性评价情况等。
国内医药大健康行业政策法规解读
本周国内医药大健康行业政策法规速览
本部分简要列出了本周发布的国内医药大健康行业政策法规,包括发布日期、标题和颁发部门等信息。
本周重点行业政策详细说明
本部分对本周发布的重点政策法规进行了详细解读,包括《国家药监局关于发布支持化妆品原料创新若干规定的公告(2025年第12号)》和《国家药监局关于修订甲磺酸吉米沙星片说明书的公告(2025年第13号)》,分析了政策的背景、内容和意义。
全球创新药研发概览
本周全球TOP10创新药研发进展
本部分总结了本周全球TOP10创新药研发进展,包括时间、公司、产品、靶点、适应症、国家和研发进展等信息。重点介绍了多域生物、君实生物、复宏汉霖、金赛药业、优锐医药、华润双鹤、科伦博泰、赛诺菲、神州细胞和东阳光药等公司在研产品的研发进展。
本周全球TOP10积极/失败临床结果
本部分总结了本周全球TOP10创新药临床试验结果,包括时间、公司、产品、靶点、适应症以及临床数据(有效性)等信息。重点介绍了GH Research、Cumberland、Algiax、Kura Oncology & Kyowa Kirin、Qlaris Bio、Equillium、Sangamo、Denali、诺和诺德和基因泰克等公司在研产品的临床试验结果。
总结
本报告基于摩熵咨询提供的医药行业观察周报数据,对2025年2月3日至2025年2月9日期间中国及全球医药市场创新药、仿制药及生物类似物研发和审批动态进行了全面分析。数据显示,国内创新药研发持续加速,获批临床数量显著;仿制药一致性评价进展迅速,生物类似物申报活跃;国家政策法规持续完善,推动医药行业高质量发展。全球范围内,多个创新药临床试验取得积极结果,为相关疾病的治疗带来了新的希望。 本报告的数据分析为医药行业从业者提供了重要的市场信息和参考依据。 需要注意的是,本报告仅基于一周的数据进行分析,结论的长期有效性需要进一步观察和验证。 更详细的数据和分析,可通过摩熵数据库获取。
-

摩熵咨询医药行业观察周报(2026.01.26-2026.02.01)
-

2026年1月仿制药月报
-

2026年1月全球在研新药月报
-

摩熵咨询医药行业观察周报(2026.01.19-2026.01.25)
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 医药日报:阿斯利康Datroway获FDA优先审评资格
- 基础化工行业周报:原油、涤纶长丝价格上涨,关注地缘局势
- 医疗卫生行业:新冠肺炎全球风险评估-第9版
- 医药日报:诺华司库奇尤单抗新适应症在华获批
- 医药生物行业周报:诺华siRNA降脂药物在华获批新适应症,关注PCSK9及小核酸赛道
- 农化行业:2026年1月月度观察:钾肥合同价上涨,储能拉动磷矿需求,草铵膦将取消出口退税
- 医药日报:Lirafugratinib向FDA递交NDA
- 2025年中国生物创新药市场跟踪报告:司美格鲁肽2025年第一季度市场回顾
- 医药产业研究第9期:AlphaGenome首次揭开基因“暗物质”;中美创新药,监管比拼“全球首发”
- 医药生物行业周报:多家公司业绩预喜,创新药进入盈利兑现期
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送