-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

2025年9月全球在研新药月报
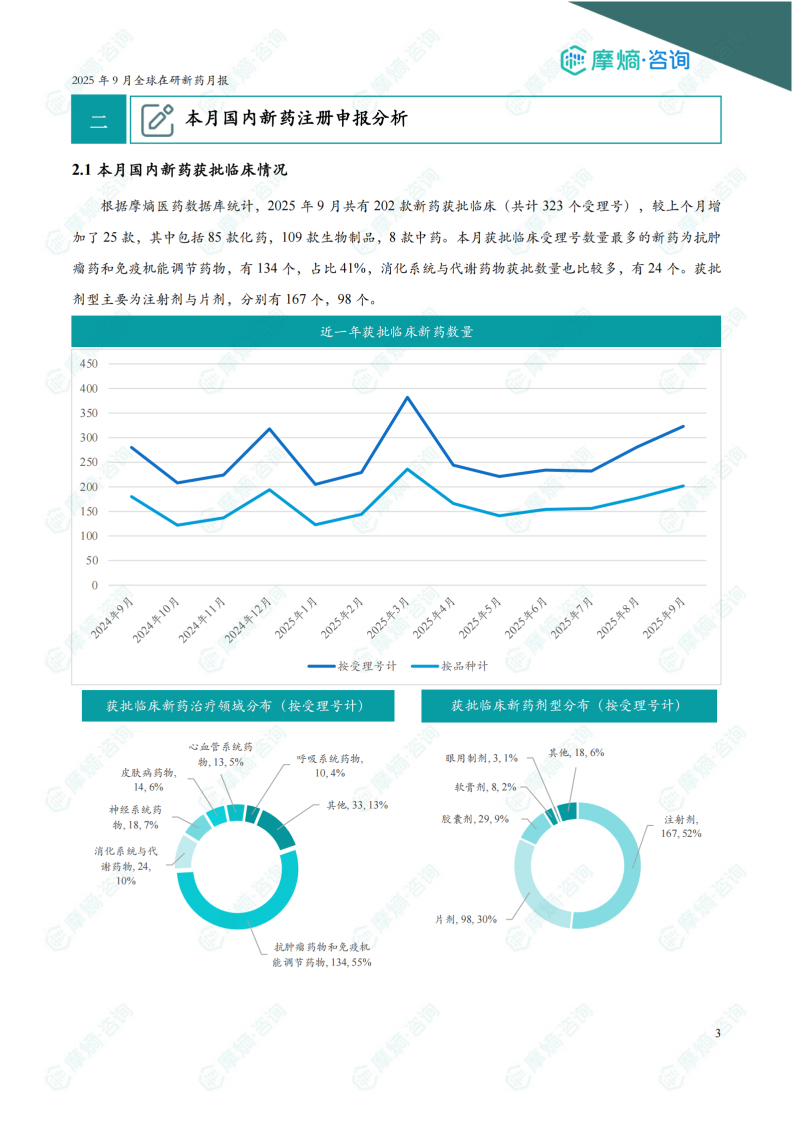
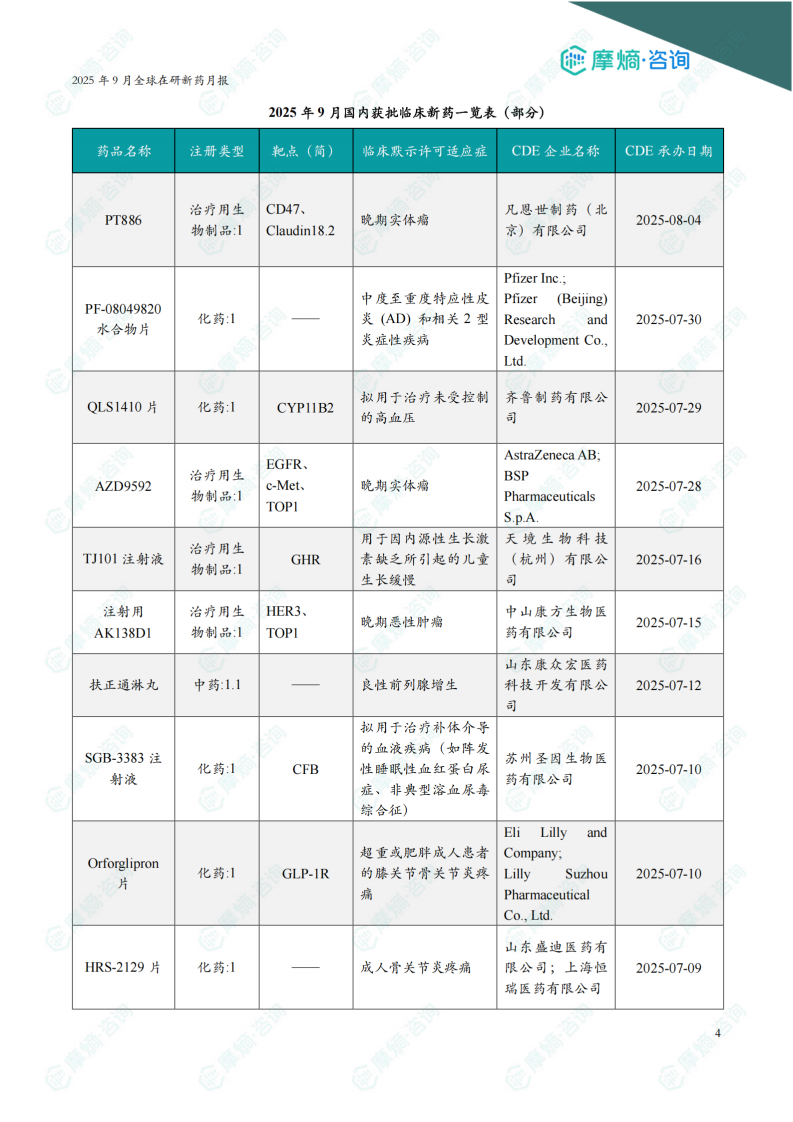
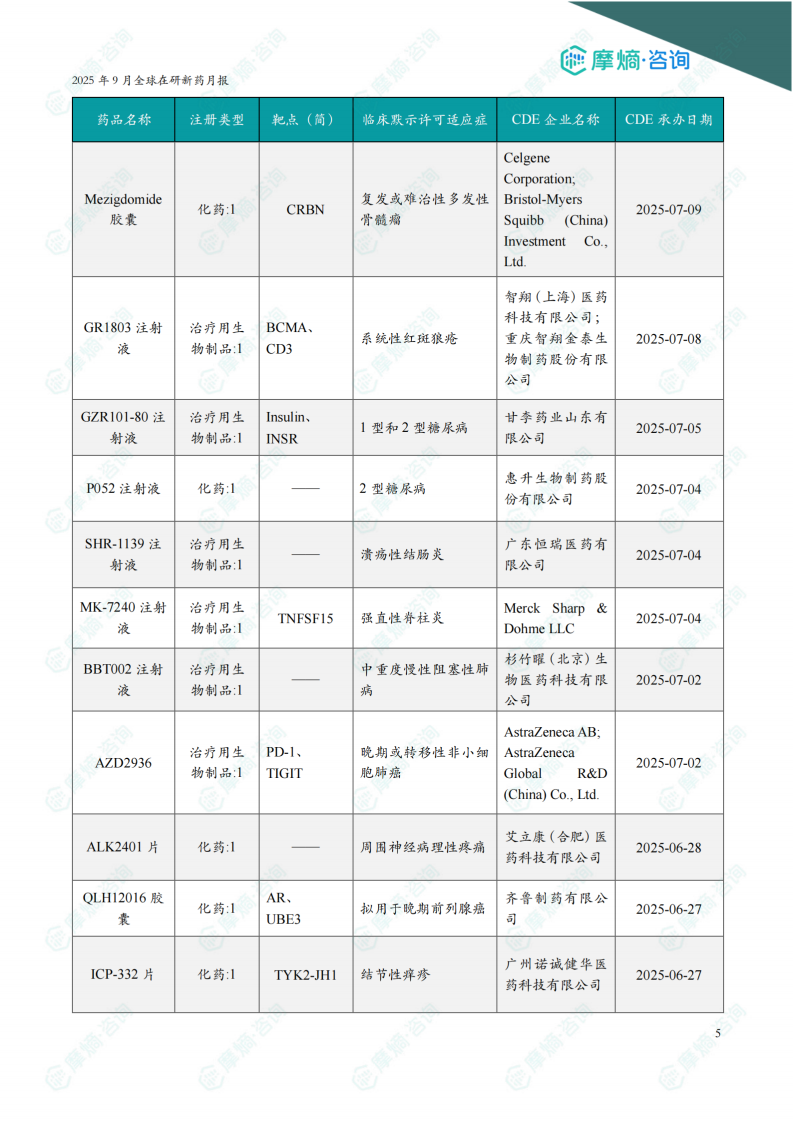
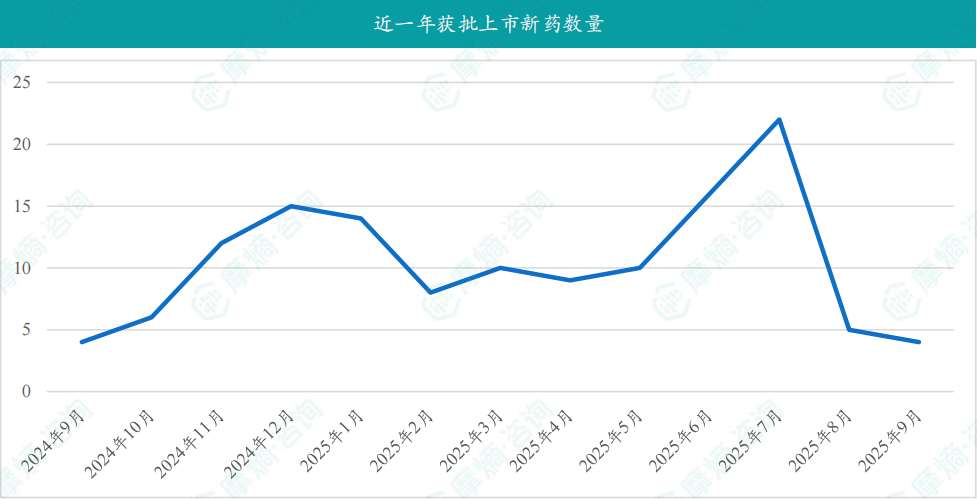
根据摩熵医药数据库统计,2025年9月共有202款新药获批临床(共计323个受理号),较上个月增加了25款,其中包括85款化药,109款生物制品,8款中药。
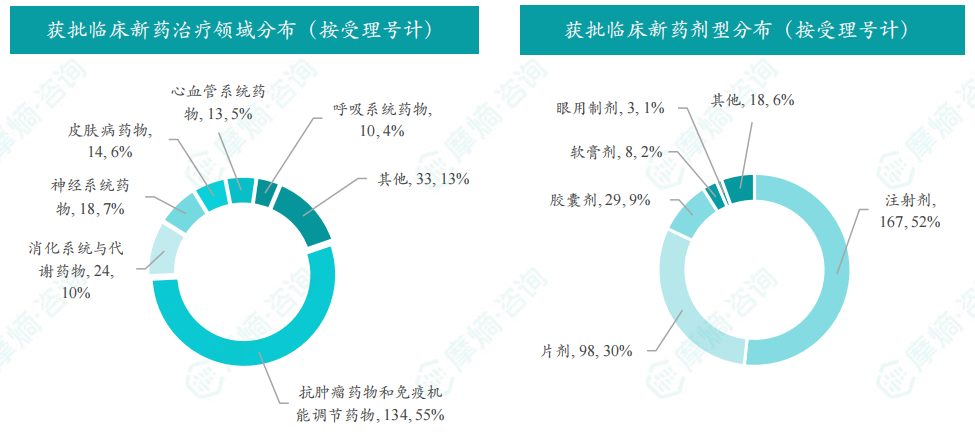
本月获批临床受理号数量最多的新药为抗肿瘤药和免疫机能调节药物,有134个,占比41%,消化系统与代谢药物获批数量也比较多,有24个。
获批剂型主要为注射剂与片剂,分别有167个,98个。
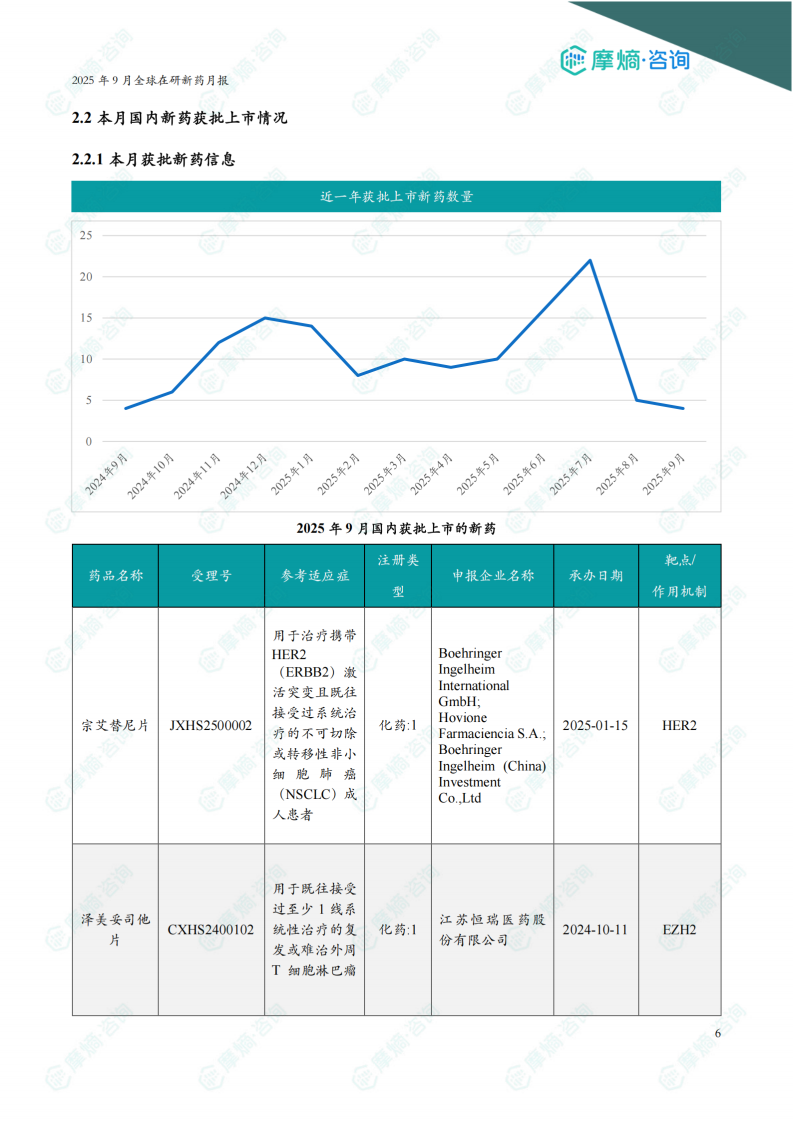
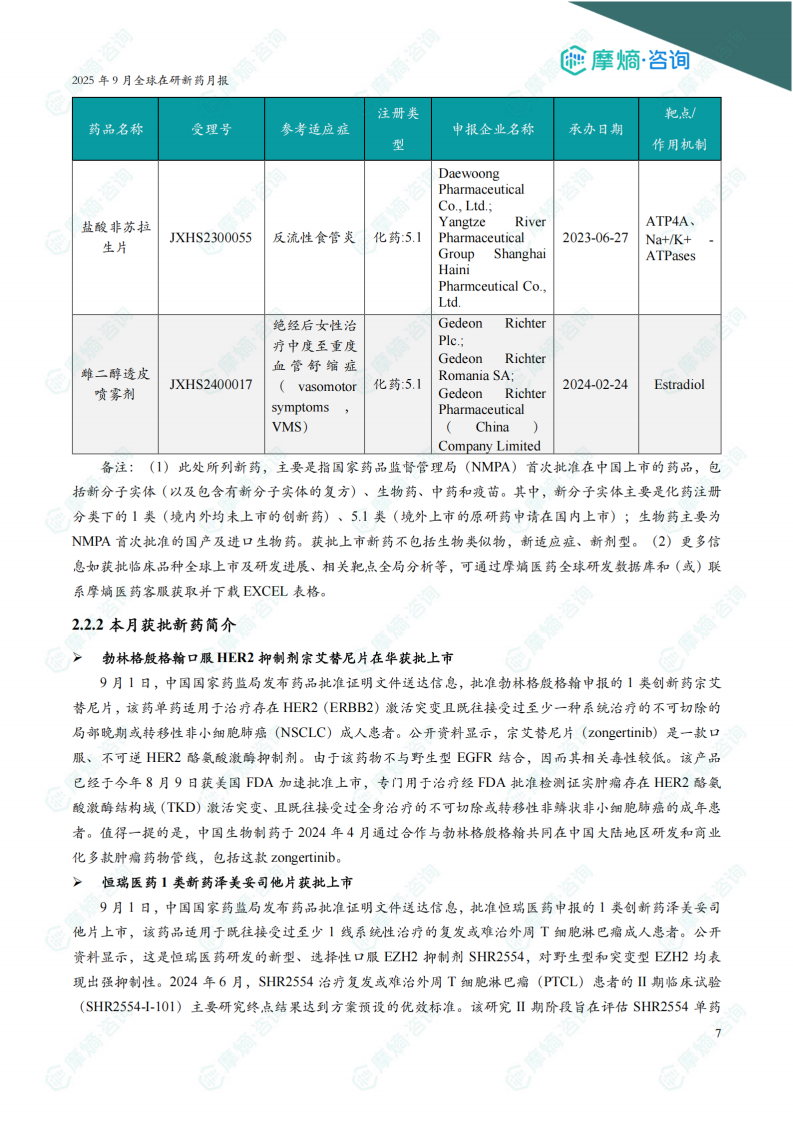
本报告涉及: 相关药物:宗艾替尼片, 相关靶点:HER2, 相关适应症:非小细胞肺癌 。
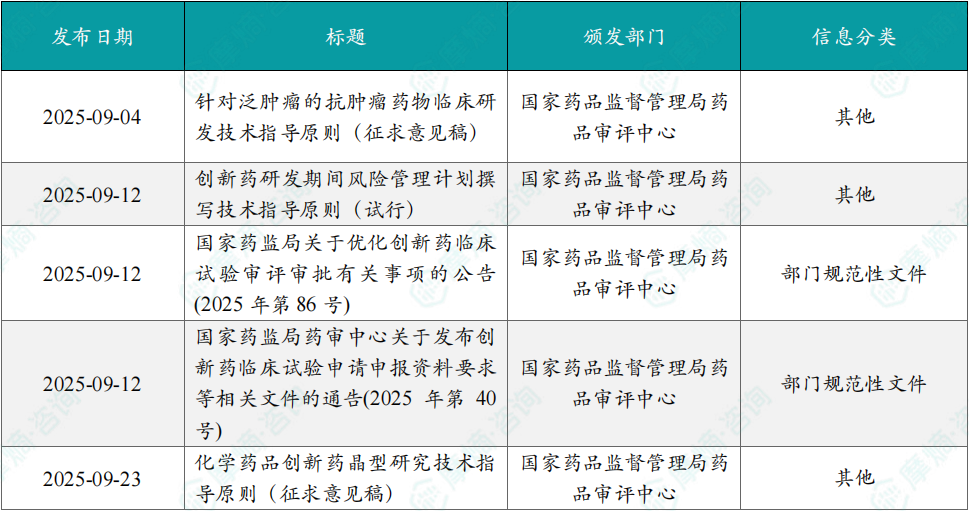
创新药最新政策速递 重点政策解读 国家药监局药审中心征求泛肿瘤药临床技术指导原则意见 9月4日,国家药监局药审中心发布关于公开征求《针对泛肿瘤的抗肿瘤药物临床研发技术指导原则(征求意见稿)》意见的通知。针对泛肿瘤的抗肿瘤药物研发是当前新药研发的热点之一。由于泛肿瘤不同于传统基于病理组织定义的肿瘤,因此泛肿瘤药物的研发也有不同于常规抗肿瘤药物研发、需关注的问题。另一方面,泛肿瘤药物通常是针对肿瘤驱动因素的靶向治疗手段,因其治疗精准性而往往显示出突出的疗效。通过创新性的科学设计,将有利于加速疗效突出的抗肿瘤药物上市,尽早满足肿瘤患者,特别是伴有罕见突变的罕见肿瘤患者未满足的临床需求。本指导原则旨在阐述当前针对泛肿瘤药物临床研发中相关技术问题的考虑。本指导原则适用于抗肿瘤治疗性药物,不涵盖细胞治疗和基因治疗产品。本指导原则仅代表药品监管部门当前的观点和认知,不能涵盖在抗肿瘤新药研发中遇到的所有情况,随着科学技术与试验方法的发展,相关内容将不断完善与更新。 国家药监局药审中心发布创新药研发期间风险管理计划撰写技术指导原则 9月12日,国家药监局药审中心发布《创新药研发期间风险管理计划撰写技术指导原则(试行)》,该指导原则旨在规范创新药研发期间风险管理计划(DRMP)的撰写,确保临床试验中安全性风险的有效监测、识别、评估和控制,保障受试者安全,同时涵盖可能影响数据可靠性的风险,适用于创新药临床试验阶段的风险管理。该指导原则为申请人提供了系统性框架,强调全生命周期风险管理,有助于提升创新药研发的安全性和可靠性。 国家药监局关于优化创新药临床试验审评审批有关事项的公告 9月12日,国家药监局发布关于优化创新药临床试验审评审批有关事项的公告,通过政策引导与多方协同,提升临床研发质量和效率,加速完成试点创新药临床试验申请审评审批,优化我国创新药临床试验研发生态。药品审评审批制度改革以来,国家药监局持续优化临床试验管理,促进药物创新研发。2019年实施60日默示许可后,药物临床试验审评审批效率大幅提升,通过一系列努力,我国药物临床试验审评审批平均用时缩减至约50个工作日,有力推动了创新药研发提速,支持了我国药物研发产业链融入全球研发体系,加快新药好药上市步伐。我国临床研发资源丰富,近年来我国药物临床试验机构和专业人员的经验、能力不断提升,早期、深入参与全球研发创新的条件已趋成熟。为此,国家药监局统筹现有审评审批资源,在60日默示许可基础上增设30日通道,在不影响60日默示许可通道审评审批效率的前提下,对部分有进一步加速需求的临床试验申请再提速。 国家药监局药审中心发布创新药临床试验申请申报资料要求 9月12日,国家药品监督管理局药品审评中心(CDE)发布了《创新药临床试验申请申报资料要求》等相关文件,旨在落实国家近期发布的医药改革政策,为创新药临床试验提供了更为明确的申报指南。 根据国家药监局最新公告,对符合要求的创新药临床试验申请,可在受理后30个工作日内完成审评审批。而纳入30日通道的中药、化学药品、生物制品1类创新药临床试验申请,应当满足以下条件之一:获国家全链条支持创新药发展政策体系支持的具有明显临床价值的重点创新药品种。国家药监局药品审评中心公布的符合条件的儿童创新药、罕见病创新药,以及中药创新药品种。全球同步研发品种(全球同步研发品种的Ⅰ期、Ⅱ期临床试验,或我国药物临床试验机构主要研究者牵头/共同牵头开展的III期国际多中心临床试验)。同时,申请人需要承诺在获批后12周内启动临床试验。 文件强调了创新药生产工艺、质量研究及对临床试验风险的管控要求。另外,沟通交流机制也得到了优化,申请人需要简述与监管机构沟通交流的情况,包括历次沟通交流会议编号,监管机构给予书面反馈或召开会议列出主要反馈意见、双方达成的重要共识及遗留问题。这一机制有助于提高审评效率,减少因信息不对称导致的申报缺陷。 国家药监局药审中心公开征求化学药品创新药晶型研究技术指导原则意见 9月23日,国家药监局药审中心网站公开征求《化学药品创新药晶型研究技术指导原则(征求意见稿)》意见,本指导原则结合创新药的特点和晶型研究的现状,并参考国内外晶型研究相关指导原则起草,旨在明确创新药晶型研究过程中的关注点及一般原则,涉及的晶型包括无水物、水合物、溶剂合物和无定型等。本指导原则适用于化学药品创新药的晶型研究。改良型新药品型的研究可参考本指导原则进行。应用本指导原则时,建议申请人同时参考药学研究相关技术要求,按照创新药研发一般规律开展研究。本指导原则仅代表药品监管部门当前的观点和认知,不具有强制性的法律约束力。随着科学研究的进展,本指导原则中的相关内容将不断完善与更新。
-

摩熵咨询医药行业观察周报(2026.02.23-2026.03.01)
-

2026年2月仿制药月报
-

2026年2月全球在研新药月报
-

摩熵咨询医药行业观察周报(2026.02.09-2026.02.22)
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送