-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

摩熵咨询医药行业观察周报(2025.06.02-2025.06.08)
根据摩熵医药数据库统计,2025.06.02-2025.06.08期间共有58个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号43个,进口药品受理号15个。
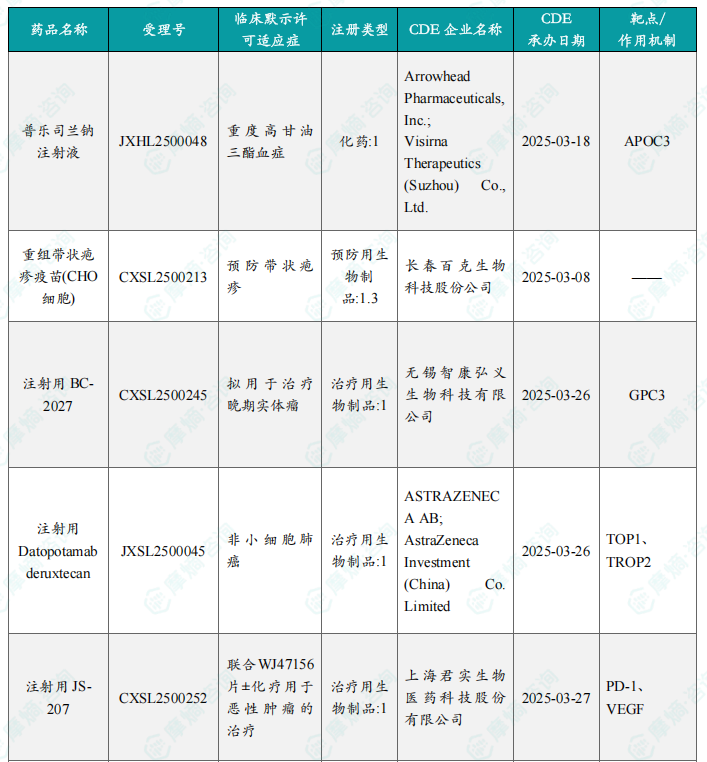
本周共计24款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药10款,生物药12款,中药2款。其中值得注意的有:
(1)注射用BC-2027
6月3日,CDE官网公示:智康弘义的注射用BC-2027获得临床试验默示许可,用于治疗晚期实体瘤。公开资料显示,注射用BC-2027是一款靶向GPC3的抗体偶联药物(ADC),此前已经在美国获批临床。在临床前研究中,BC2027表现出较好的GPC3结合和内吞活性。该分子采用了对肝细胞癌、鳞状非小细胞肺癌等肿瘤更敏感、且具有旁观者效应的有效载荷(Payload)以提升肿瘤杀伤活性,在多种肿瘤模型中的肿瘤生长抑制率(TGI)均超过90%(最高超过100%)。
(2)XH-001注射液
6月4日,CDE官网公示:新合生物的XH-001注射液获得临床试验默示许可,用于复发高危实体瘤患者根治术后的辅助治疗,主要包括胰腺导管腺癌、胆道恶性肿瘤、肝细胞癌和胃腺癌等。公开资料显示,XH-001注射液是一款个性化肿瘤新抗原疫苗。通过筛选高免疫原性新抗原,该疫苗可激活肿瘤特异性T细胞,精准清除残余肿瘤细胞,从源头降低复发风险。
(3)NH-104片
6月4日,CDE官网公示:恩华药业的NH-104片获得临床试验默示许可,用于失眠及抑郁症伴失眠的治疗。公开资料显示,NH-104片为新一代治疗失眠及抑郁症伴失眠的创新药。临床前试验结果表明,NH104具有较强的抗失眠及辅助抗抑郁药效,安全性和药代动力学特性良好。
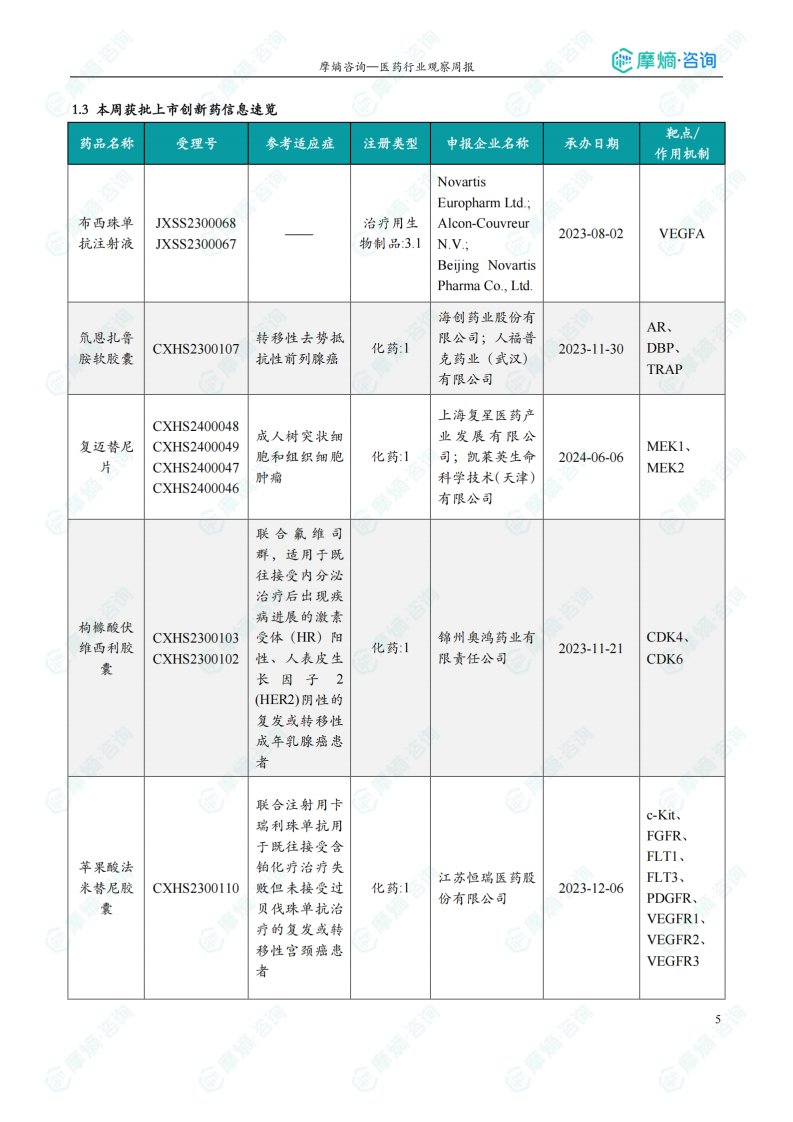
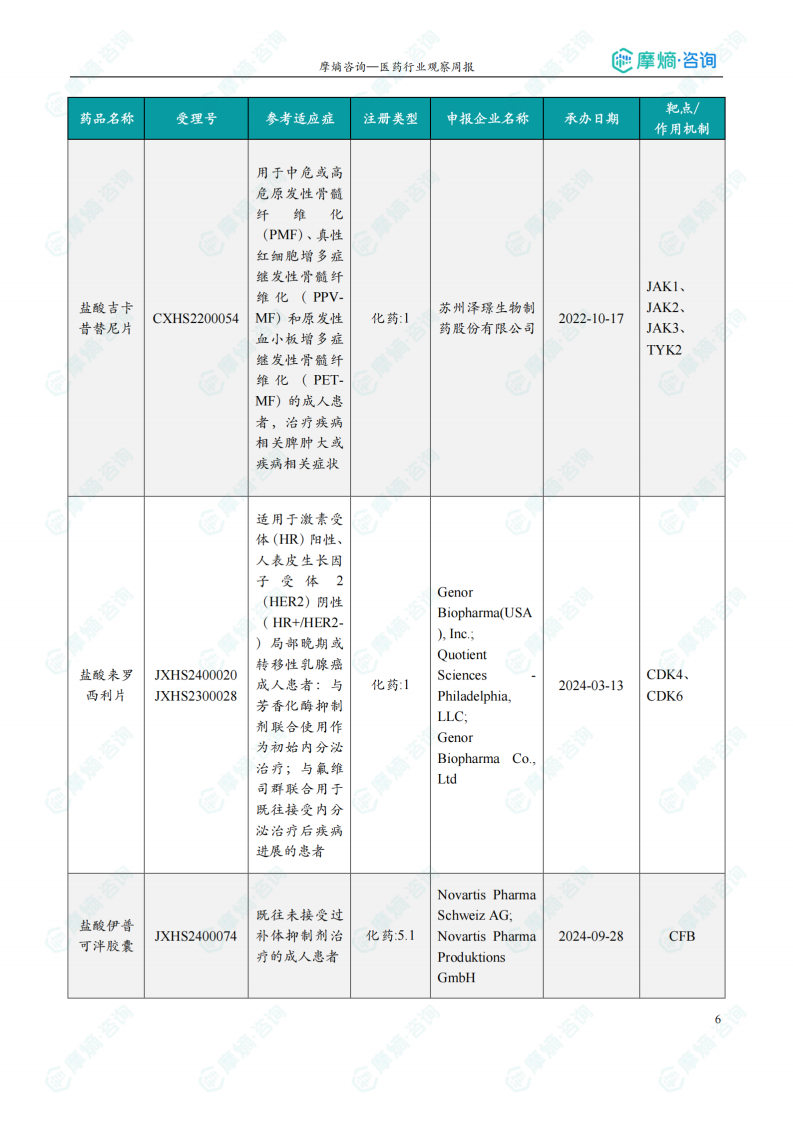
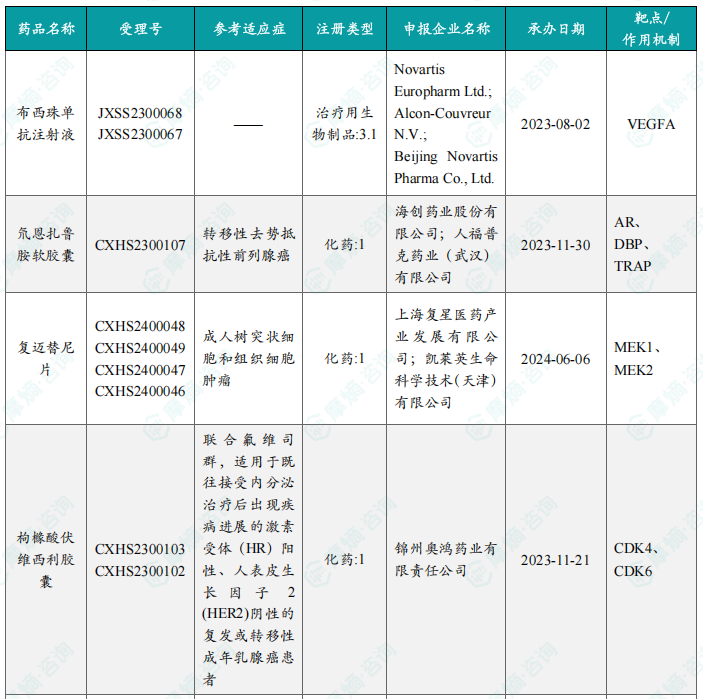
本周共13款新药获批上市,即布西珠单抗注射液、氘恩扎鲁胺软胶囊、复迈替尼片、枸橼酸伏维西利胶囊、苹果酸法米替尼胶囊、盐酸吉卡昔替尼片、盐酸来罗西利片、盐酸伊普可泮胶囊、怡培生长激素注射液、注射用HR-20013、注射用瑞康曲妥珠单抗、注射用泽尼达妥单抗和注射用重组(酵母分泌型)人血清白蛋白-人粒细胞集落刺激因子(Ⅰ)融合蛋白。
本报告涉及: 相关药物:氘恩扎鲁胺软胶囊, 相关靶点:AR、DBP、TRAP, 相关适应症:转移性去势抵抗性前列腺癌 。
中心思想
本报告基于摩熵咨询医药数据库,对2025年6月2日至8日一周内中国及全球医药行业创新药、仿制药及政策法规动态进行数据分析,核心观点如下:
国内创新药研发进展迅速,获批上市品种涵盖多个治疗领域
国内创新药研发持续活跃,本周多个创新药获批临床或上市,涵盖肿瘤、心血管、神经系统等多个治疗领域,体现了中国医药创新能力的提升。
国内仿制药一致性评价稳步推进,部分品种竞争激烈
国内仿制药一致性评价工作持续推进,本周多个品种通过或视同通过评价,但部分品种竞争激烈,企业数量众多。
主要内容
一、 国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
1.1 总体概况
本周共有58个创新药/改良型新药临床申请/上市申请获CDE承办,其中国产药43个,进口药15个。24款创新药/改良型新药临床试验申请获得“默示许可”,13款新药获批上市。值得关注的是智康弘义的注射用BC-2027(靶向GPC3的ADC)、新合生物的XH-001注射液(个性化肿瘤新抗原疫苗)以及恩华药业的NH-104片(治疗失眠及抑郁症伴失眠的创新药)均获得临床试验默示许可。获批上市的药品包括布西珠单抗注射液、氘恩扎鲁胺软胶囊、复迈替尼片等,涵盖多个治疗领域。其中,恒瑞医药的苹果酸法米替尼胶囊、海创药业的氘恩扎鲁胺软胶囊以及锦州奥鸿药业的枸橼酸伏维西利胶囊等均为具有自主知识产权的创新药物。
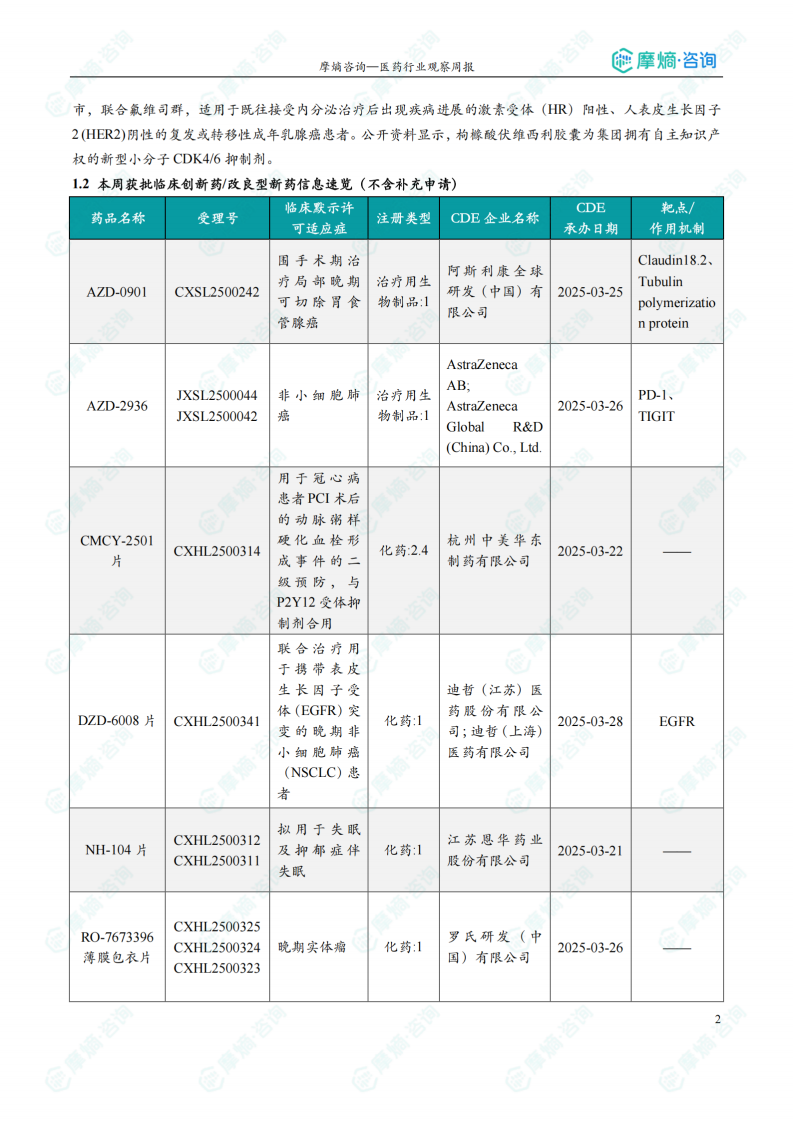
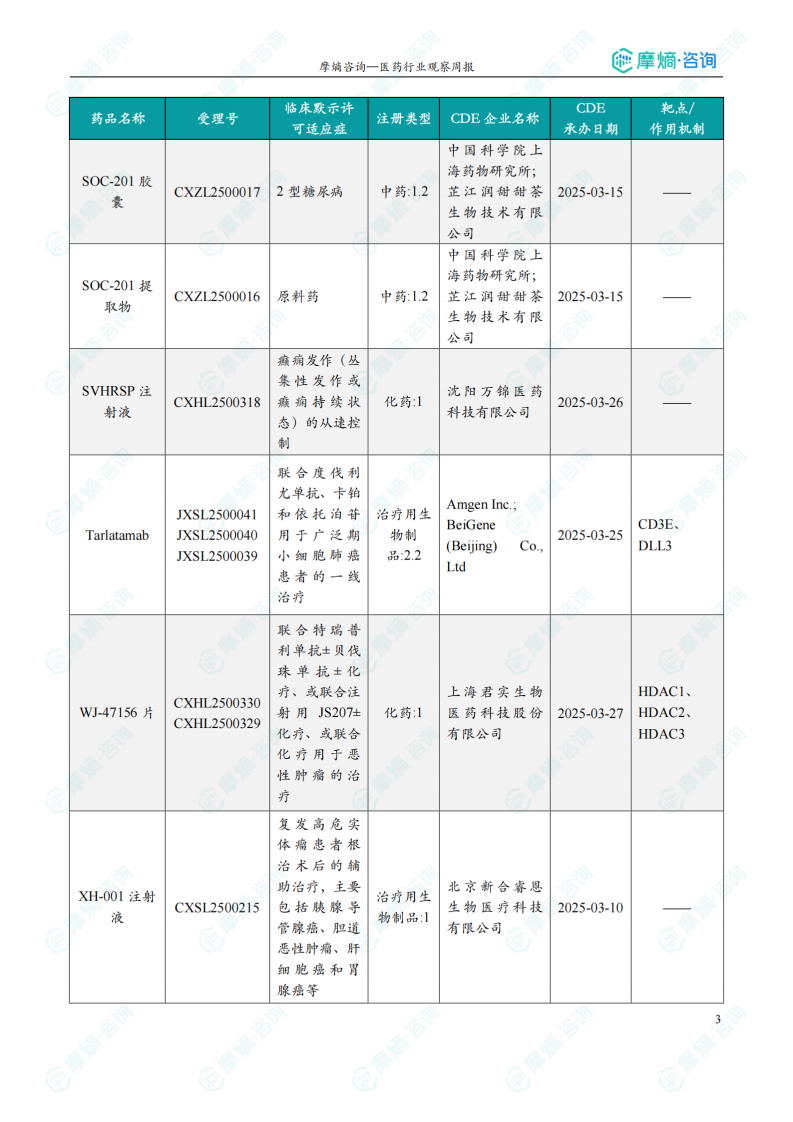
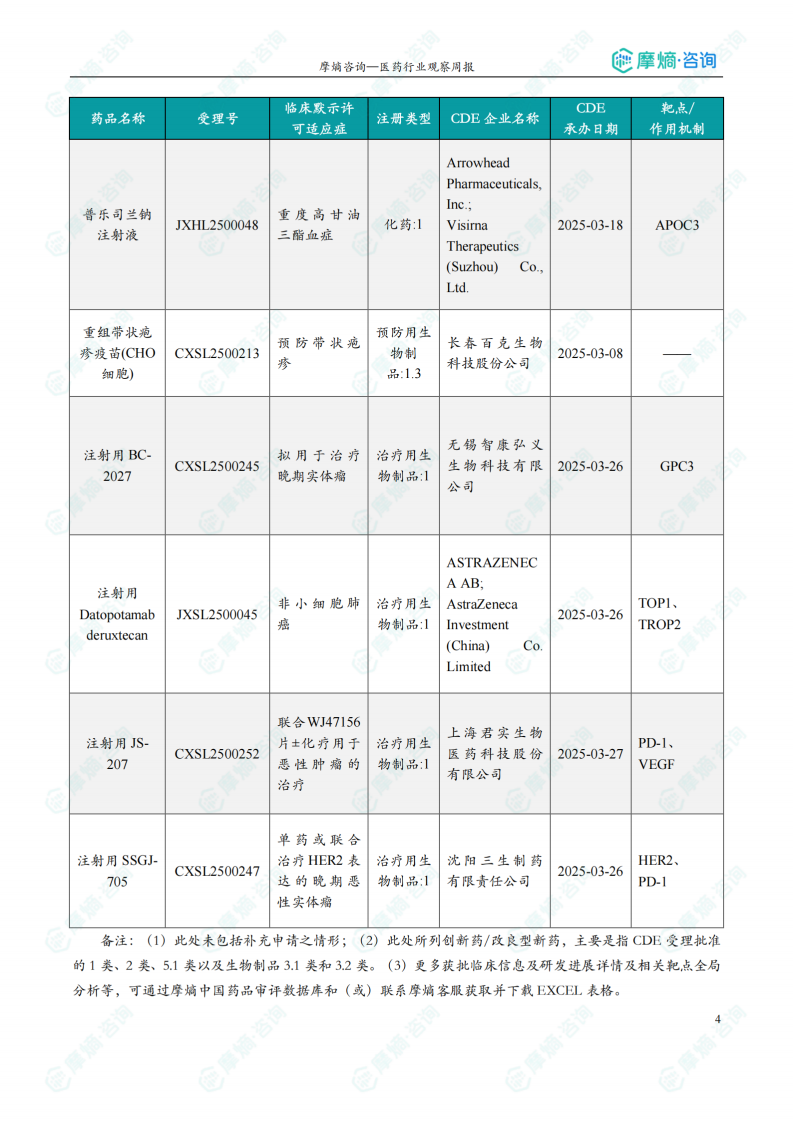
1.2 本周获批临床创新药/改良型新药信息速览(不含补充申请)
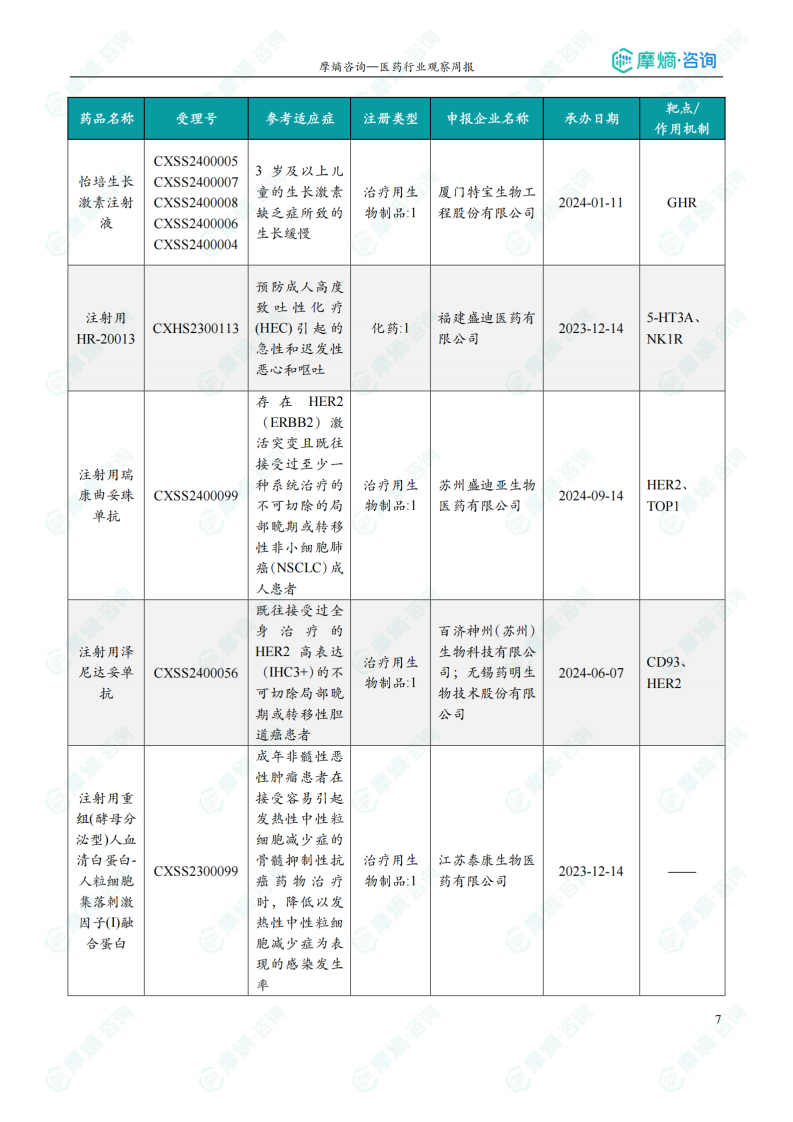
本节详细列出了本周获批临床的创新药/改良型新药信息,包括药品名称、受理号、注册类型、企业名称、适应症、承办日期以及作用机制等。数据显示,获批临床的药品靶点多样,作用机制涵盖了靶向治疗、免疫治疗等多个方面。
1.3 本周获批上市创新药信息速览
本节详细列出了本周获批上市的创新药信息,包括药品名称、受理号、适应症、注册类型、申报企业名称、承办日期以及作用机制等。数据显示,获批上市的药品涵盖了肿瘤、心血管等多个治疗领域,体现了国内创新药研发的进展。
二、 国内仿制药/生物类似物申报/审批数据分析
2.1 总体概况
本周共有85项仿制药申报上市/申报临床获CDE承办,其中包括新注册分类上市申请70项,新注册分类临床申请5项,一致性评价申请10项。8个品种通过一致性评价,102个品种视同通过一致性评价。本周有4项生物类似物注册申报动态。
2.2 本周通过/视同通过一致性评价全局分析
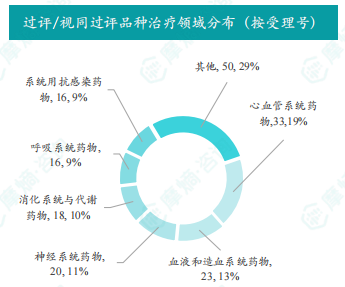
本周过评/视同过评品种主要为心血管系统药物,剂型主要为注射剂。腺苷钴胺胶囊过评/视同过评受理号数量最多,达可替尼片和他达拉非片过评/视同过评企业最多。浙江高跖医药科技股份有限公司、山东齐都药业有限公司和成都苑东生物制药股份有限公司过评/视同过评品种数最多。报告还提供了过评/视同过评品种治疗领域分布和剂型分布图表,以及品种和企业过评/视同过评数量排名榜。
2.3 本周首次过评/视同过评、过评/视同过评达7家品种盘点
本节分别盘点了本周首次过评/视同过评品种和过评/视同过评达7家企业以上的品种,提供了详细的药品信息,包括药品名称、受理号、申报企业、适应症、注册类型、一致性评价情况等。
三、 本周国内医药大健康行业政策法规汇总
3.1 本周国内医药大健康行业政策法规速览
本节简要列出了本周发布的国内医药大健康行业政策法规,包括发布日期、标题和颁发部门。
3.2 本周重点行业政策详细说明
本节对本周重点政策——《关于进一步完善医药价格和招采信用评价制度的通知》进行了详细解读,包括修订内容、评价标准调整以及惩戒力度加大等方面。
四、 本周全球创新药研发概览
4.1 本周全球TOP10创新药研发进展
本节列举了本周全球TOP10创新药研发进展,包括时间、公司、产品、靶点、适应症、国家和研发进展等信息。详细介绍了翰森制药阿美替尼获批上市、百时美施贵宝罗特西普获批新适应症、康方生物卡度尼利单抗获批新适应症等重要事件。
4.2 本周全球TOP10积极/失败临床结果
本节列举了本周全球TOP10创新药临床试验结果,包括时间、公司、产品、靶点、适应症以及临床数据等信息。详细介绍了Genmab公司rinatabart sesutecan 1/2期临床试验数据、ImCheck Therapeutics公司ICT01 1/2期联合治疗试验数据、ORIC Pharmaceuticals公司ORIC-944 1b期联合治疗试验初步数据等临床试验结果。
总结
本报告通过对一周内中国及全球医药行业数据的分析,展现了国内外医药行业创新药研发、仿制药一致性评价以及政策法规动态。国内创新药研发持续活跃,获批上市品种涵盖多个治疗领域;国内仿制药一致性评价稳步推进,部分品种竞争激烈;全球范围内,多个创新药取得积极的临床试验结果,为相关疾病的治疗带来了新的希望。 本报告数据来源于摩熵咨询医药数据库,更详细的数据和分析可通过摩熵医药数据库或联系摩熵客服获取。
-

摩熵咨询医药行业观察周报(2026.02.23-2026.03.01)
-

2026年2月仿制药月报
-

2026年2月全球在研新药月报
-

摩熵咨询医药行业观察周报(2026.02.09-2026.02.22)
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送