-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

摩熵咨询医药行业观察周报(2025.05.19-2025.05.25)
根据摩熵医药数据库统计,2025.05.19-2025.05.25期间共有76个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号61个,进口药品受理号15个。
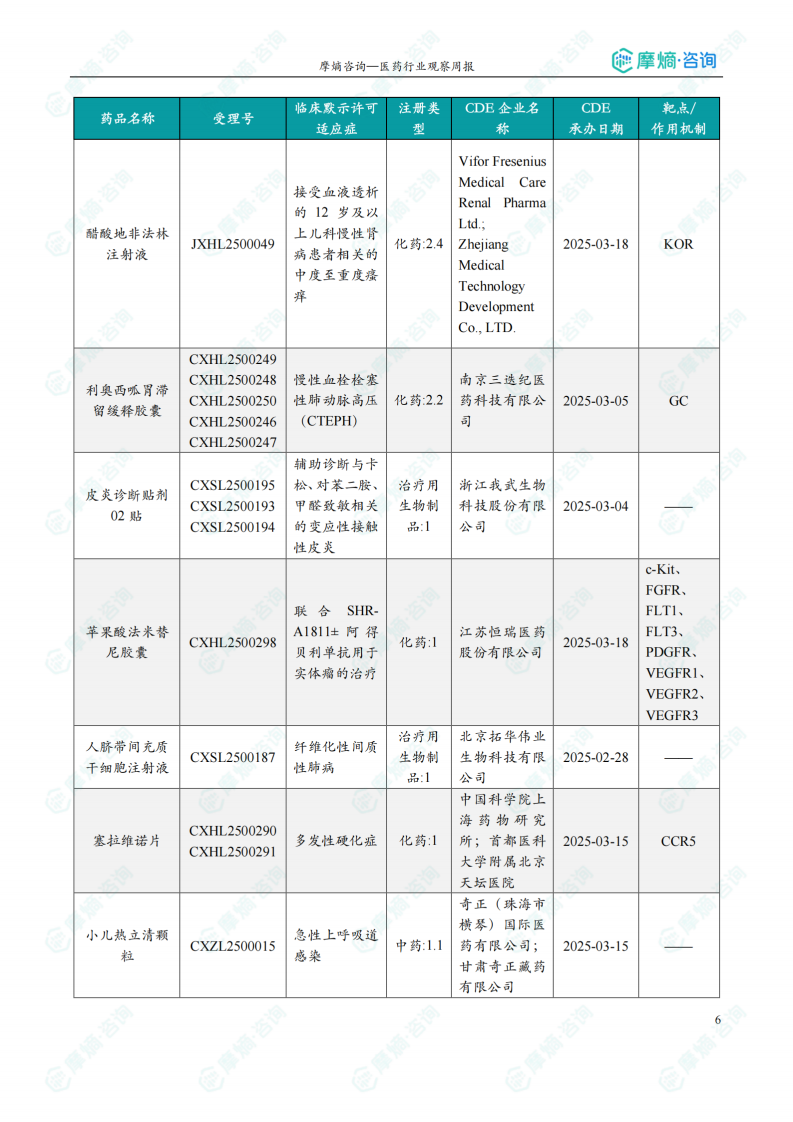
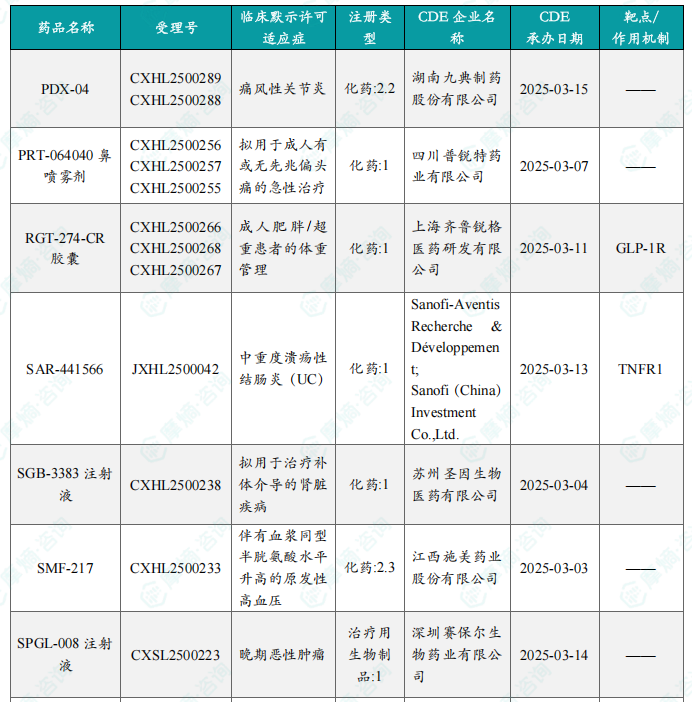
本周共计62款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药37款,生物药22款,中药3款。其中值得注意的有:
(1)SGB-3383注射液
5月19日,CDE官网公示:乐普医疗的SGB-3383注射液获得临床试验默示许可,拟用于治疗补体介导的肾脏疾病(包括IgA肾病、C3肾小球病、免疫复合物介导的膜增生性肾小球肾炎、非典型溶血尿毒综合征等)。公开资料显示,SGB-3383注射液是一款靶向补体B因子(CFB)的小核酸(siRNA)药物。该产品通过RNAi抑制肝脏中CFB的表达,从而治疗补体介导的肾脏疾病。
(2)MWX-203注射液
5月25,CDE官网公示:民为生物的MWX-203注射液获得临床试验默示许可,用于治疗血脂异常。公开资料显示,MWX-203注射液是一种抑制ANGPTL3基因表达的siRNA创新药。
(3)LY-3549492片
5月25日,CDE官网公示:礼来的LY-3549492片获得临床试验默示许可,作为饮食和运动的辅助治疗手段,用于治疗2型糖尿病(T2D),以及改善成人肥胖或超重患者的体重管理控制。公开资料显示,LY-3549492片是一款胰高血糖素样肽-1受体(GLP-1R)非肽类激动剂(NPA)。
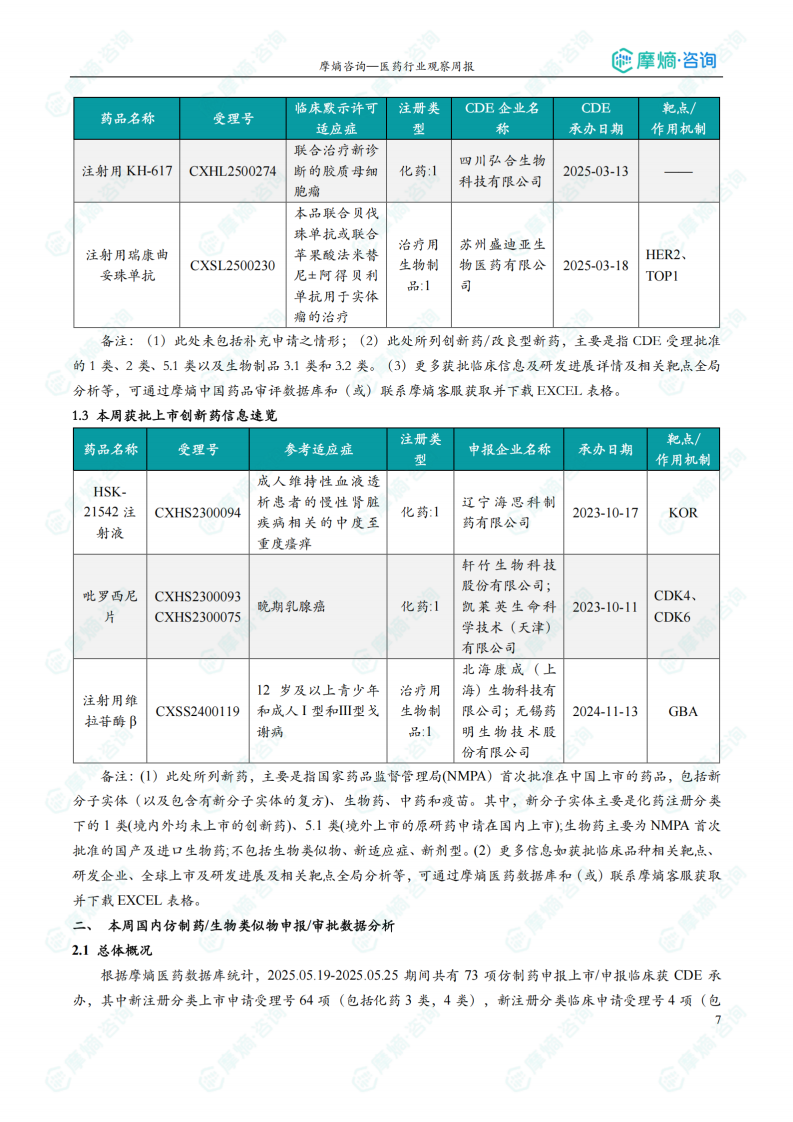
本周共3款新药获批上市,即HSK-21542注射液、吡罗西尼片和注射用维拉苷酶β。
本报告涉及: 相关药物:吡罗西尼片, 相关靶点:CDK4/6, 相关适应症:晚期乳腺癌 。
中心思想
本报告基于摩熵咨询医药数据库,对2025年5月19日至2025年5月25日期间中国及全球医药行业创新药、仿制药及相关政策法规进行了数据分析和解读。核心观点如下:
- 国内创新药研发活跃: 本周国内创新药/改良型新药临床申请/上市申请数量可观,默示许可数量显著,涵盖多个治疗领域,显示出国内创新药研发持续向好的态势。获批上市的创新药也体现了技术创新和临床需求的结合。
- 仿制药一致性评价稳步推进: 本周国内仿制药一致性评价进展顺利,多个品种通过或视同通过评价,这将进一步优化药品市场结构,提升药品质量。
- 政策法规关注适老化: 国家药监局发布的《创新药研发中涉及适老化设计时的一般原则及考虑要点(征求意见稿)》体现了国家对老年人用药需求的重视,将推动医药行业开发更适合老年人的药品。
- 全球创新药研发进展迅速: 多款创新药在全球范围内取得积极的临床试验结果,展现了新药研发领域的蓬勃活力,也为一些重大疾病的治疗带来了新的希望。
国内创新药研发进展迅速,多个领域展现活力
本周共有76个创新药/改良型新药临床申请/上市申请获CDE承办,其中国产药品61个,进口药品15个。62款创新药/改良型新药临床试验申请获得“默示许可”,涵盖化学药、生物药和中药。值得关注的是几款创新药,例如靶向补体B因子(CFB)的siRNA药物SGB-3383注射液,靶向ANGPTL3基因表达的siRNA创新药MWX-203注射液,以及GLP-1R非肽类激动剂LY-3549492片,分别针对补体介导的肾脏疾病、血脂异常和2型糖尿病等疾病。此外,本周还有3款新药获批上市,分别为治疗慢性肾脏疾病相关瘙痒的HSK-21542注射液,治疗晚期乳腺癌的吡罗西尼片,以及治疗戈谢病的注射用维拉苷酶β,体现了国内创新药研发在不同治疗领域的进展。
仿制药一致性评价持续推进,市场结构优化
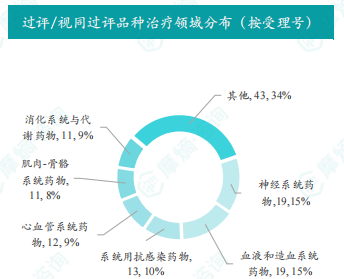
本周共有73项仿制药申报上市/申报临床获CDE承办,其中包括新注册分类上市申请和临床申请以及一致性评价申请。本周有4个品种通过一致性评价,82个品种视同通过一致性评价,涵盖神经系统药物、消化系统药物、心血管系统药物等多个治疗领域,剂型主要为注射剂和片剂。数据显示,甲硫酸新斯的明注射液、马来酸氟伏沙明片、硫酸镁注射液、二羟丙茶碱注射液和美索巴莫注射液过评/视同过评受理号数量最多,浙江华海药业股份有限公司、江苏万高药业股份有限公司和山东辰欣佛都药业股份有限公司过评/视同过评品种数最多。这表明国内仿制药一致性评价工作持续推进,市场结构不断优化,药品质量得到提升。
主要内容
国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
本部分详细分析了本周国内创新药/改良型新药的临床申请、获批临床和上市情况。数据显示,默示许可数量较多,获批上市的药品涵盖多个治疗领域,体现了国内创新药研发的活跃度和技术水平。报告中还对部分重点创新药进行了详细介绍,包括其作用机制、适应症以及研发企业等信息。
国内创新药总体概况及重点品种分析
本节提供了本周国内创新药/改良型新药申请的总体概况,包括申请数量、国产与进口药品比例等。并对一些具有代表性的创新药进行了详细分析,例如SGB-3383注射液、MWX-203注射液和LY-3549492片等,重点阐述了它们的靶点、作用机制和适应症。
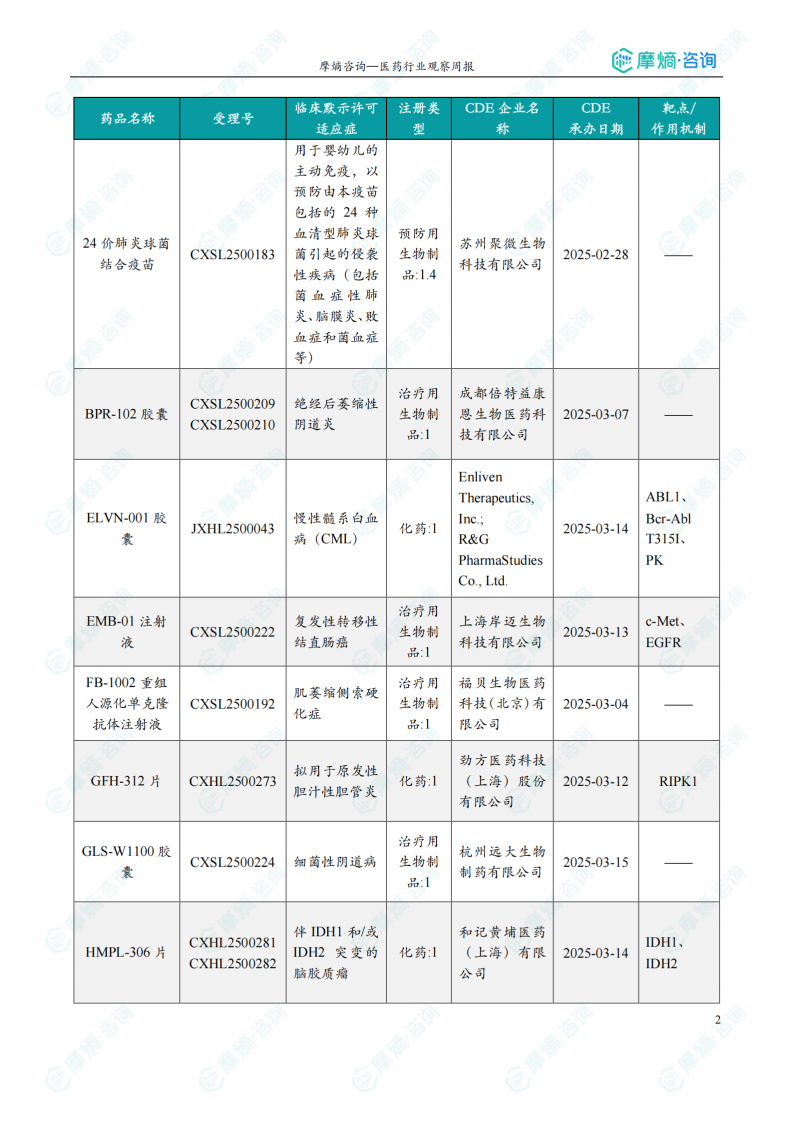
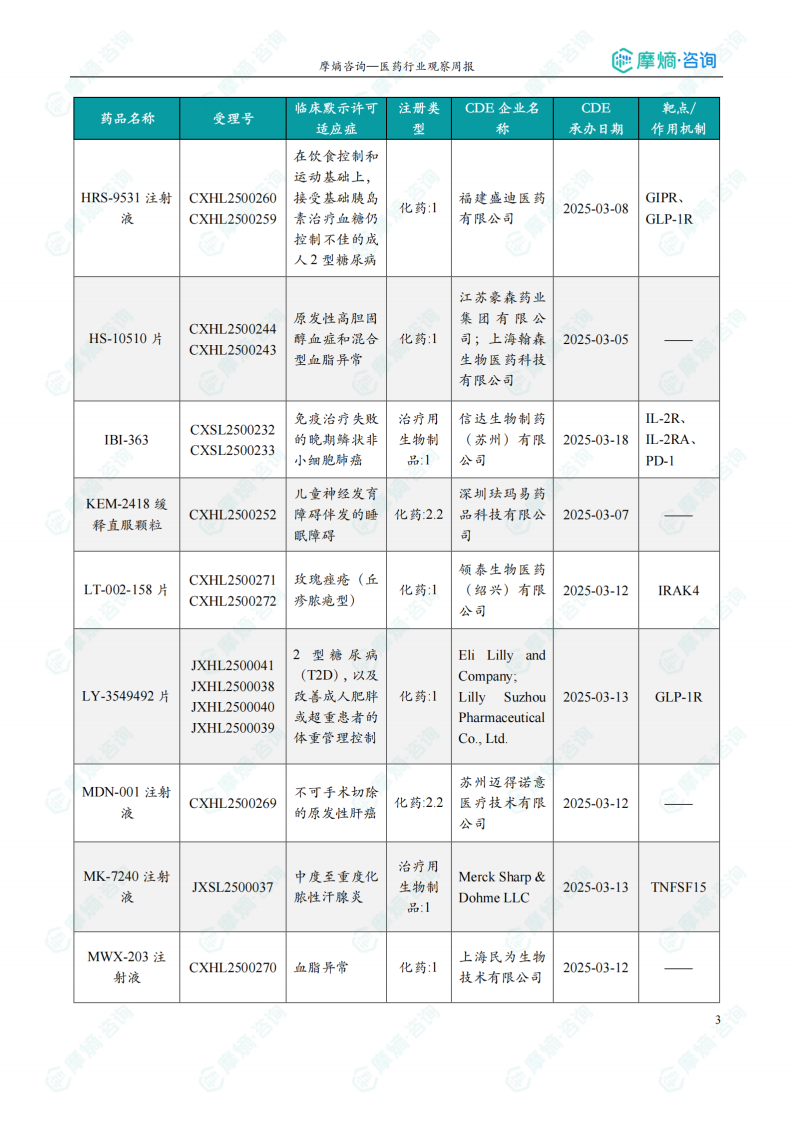
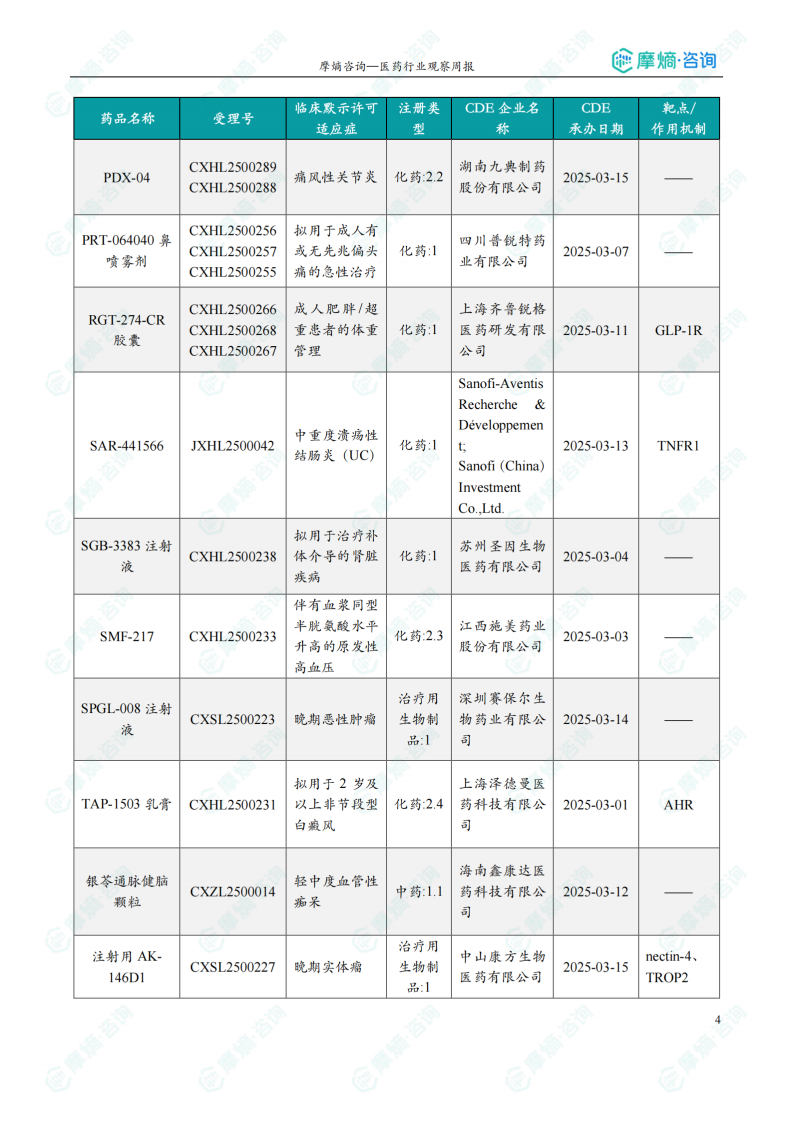
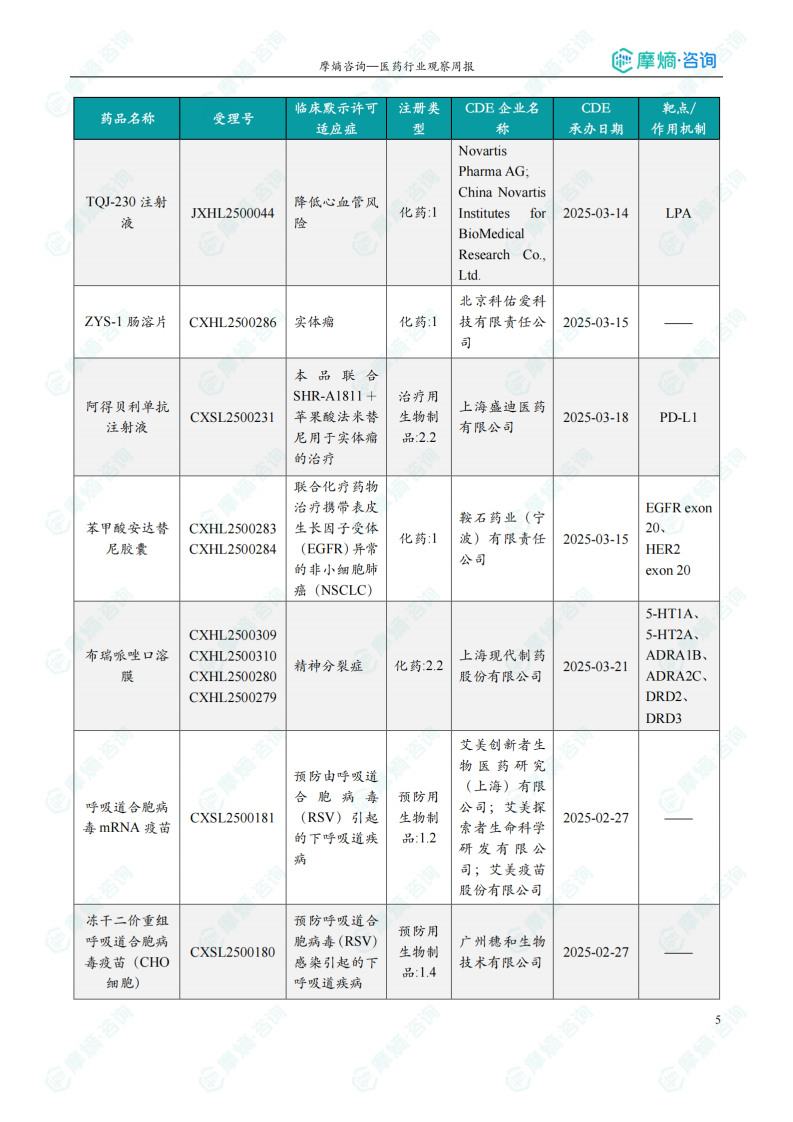
本周获批临床创新药/改良型新药信息速览
本节以表格形式对本周获批临床的创新药/改良型新药进行了信息速览,包括药品名称、受理号、适应症、研发企业、靶点和作用机制等关键信息。
本周获批上市创新药信息速览
本节以表格形式对本周获批上市的创新药进行了信息速览,包括药品名称、受理号、适应症、研发企业、靶点和作用机制等关键信息。
本周国内仿制药/生物类似物申报/审批数据分析
本部分分析了本周国内仿制药和生物类似物的申报和审批情况,数据显示一致性评价进展顺利,多个品种通过或视同通过评价。报告中还对部分重点品种进行了分析,包括其治疗领域、剂型以及申报企业等信息。
国内仿制药总体概况
本节概述了本周国内仿制药申报的总体情况,包括申报数量、类型以及一致性评价申请数量等。
本周通过/视同通过一致性评价全局分析
本节对本周通过或视同通过一致性评价的品种进行了全局分析,包括治疗领域分布、剂型分布以及企业排名等,并以图表形式直观地展现了数据结果。
本周首次过评/视同过评、过评/视同过评达7家品种盘点
本节分别对本周首次通过或视同通过一致性评价的品种和通过或视同通过评价数量达到7家的品种进行了盘点,提供了详细的药品信息和企业信息。
本周国内医药大健康行业政策法规汇总
本部分对本周发布的国内医药大健康行业政策法规进行了汇总和解读,重点关注了国家药监局发布的《创新药研发中涉及适老化设计时的一般原则及考虑要点(征求意见稿)》,分析了该政策对医药行业的影响。
本周国内医药大健康行业政策法规速览
本节以表格形式对本周发布的医药大健康行业政策法规进行了速览,包括发布日期、标题、颁发部门以及信息分类等。
本周重点行业政策详细说明
本节对本周重点政策,即《创新药研发中涉及适老化设计时的一般原则及考虑要点(征求意见稿)》进行了详细解读,分析了其背景、内容以及对医药行业的影响。
本周全球创新药研发概览
本部分对本周全球范围内具有代表性的创新药研发进展和临床试验结果进行了总结,包括获批临床、获批上市以及临床试验数据等信息。
本周全球TOP10创新药研发进展
本节对本周全球TOP10创新药研发进展进行了总结,包括公司、产品、靶点、适应症、国家以及研发进展等信息,并对部分重点药物进行了详细介绍。
本周全球TOP10积极/失败临床结果
本节对本周全球TOP10具有代表性的临床试验结果进行了总结,包括公司、产品、靶点、适应症以及临床数据等信息,并对部分重点临床试验结果进行了详细解读。
总结
本报告基于摩熵咨询医药数据库,对2025年5月19日至2025年5月25日期间中国及全球医药行业的创新药、仿制药及相关政策法规进行了数据分析和解读。报告显示,国内创新药研发持续活跃,仿制药一致性评价稳步推进,国家政策也日益关注老年人用药需求。同时,全球创新药研发进展迅速,多款创新药取得积极的临床试验结果,为一些重大疾病的治疗带来了新的希望。 这些数据和信息为医药行业从业者提供了重要的市场参考和决策依据。 未来,持续关注创新药研发、仿制药一致性评价以及相关政策法规的动态,将对把握行业发展趋势至关重要。

-

摩熵咨询医药行业观察周报(2026.01.26-2026.02.01)
-

2026年1月仿制药月报
-

2026年1月全球在研新药月报
-

摩熵咨询医药行业观察周报(2026.01.19-2026.01.25)
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 叙利亚必需药品清单(叙利亚-EML)
- 生殖健康服务获取、阻碍与保障:美国2026年运营企业须知
- 化工行业周报:国际油价上涨,分散染料、维生素E价格上涨
- 基础化工行业研究:多产品涨价,继续看好大化工板块投资机会
- 氟化工行业周报:三代制冷剂价格淡季坚挺,新一轮价格上涨或在酝酿;巨化股份、昊华科技等发布2025业绩预增公告
- 医药行业周报:技术加持稳定原料药出口竞争力
- 医药行业周报:创新药BD预期落地,建议关注低位创新药、脑机接口、AI医疗
- 医药健康行业研究:2月将迎来海外CXO龙头密集披露窗口期,行业景气度迎关键验证
- 化工行业周报:关注淡季补库涨价品种粘胶、染料,化工景气度有望持续上行
- 医药行业周报:AI技术赋能,AI医疗市场加速扩张
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送