-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

摩熵咨询医药行业观察周报(2025.01.13-2025.01.19)
一、本周国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
1.1总体概况
根据摩熵数据统计,2025.01.13-2025.01.19期间共有80个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号60个,进口药品受理号20个。
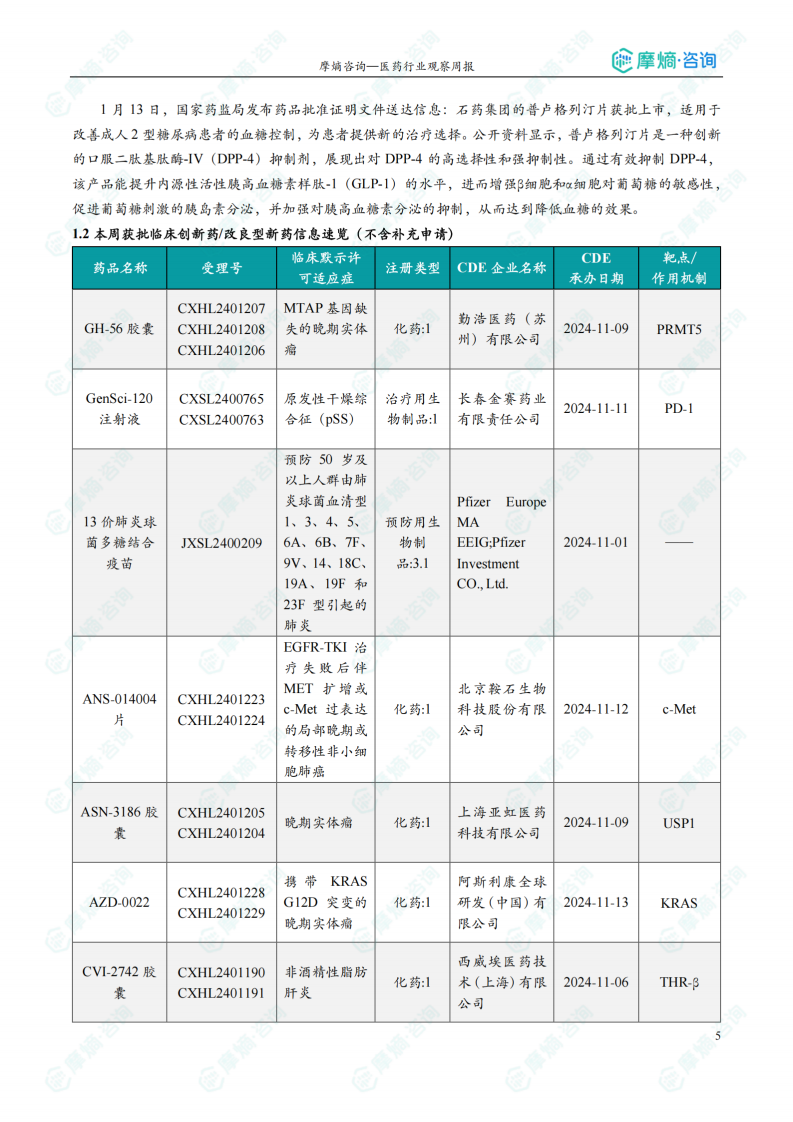
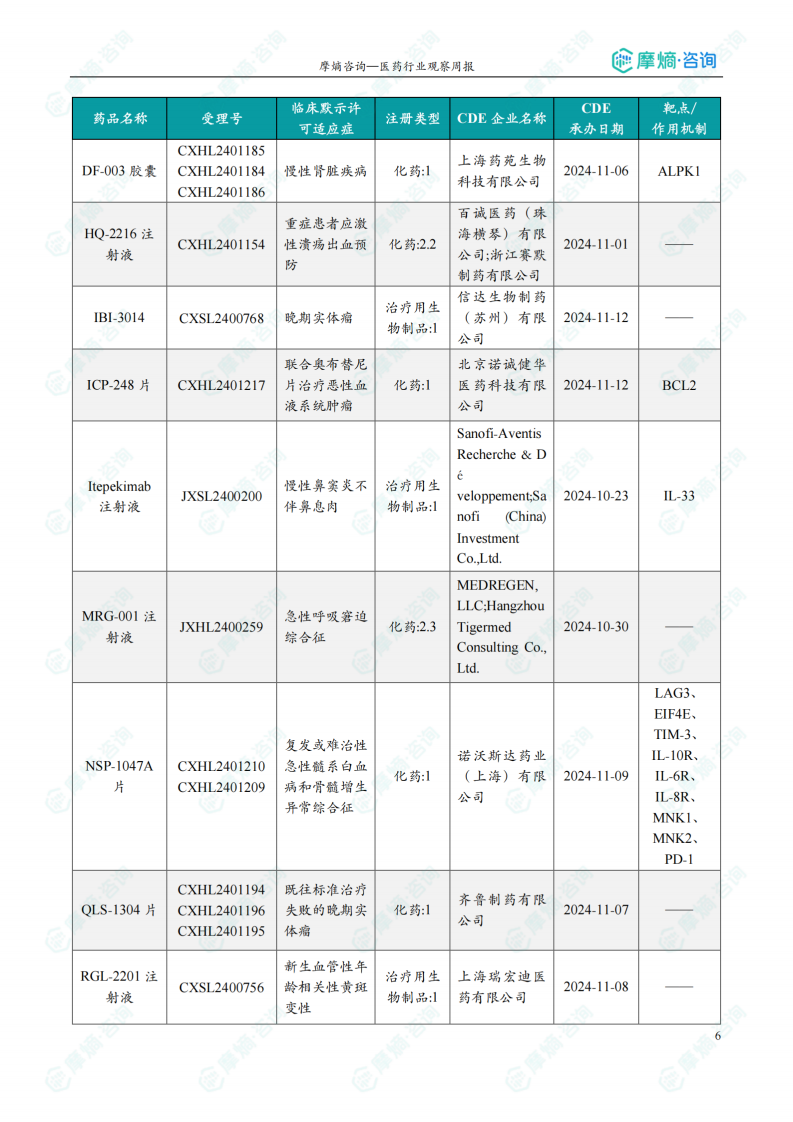
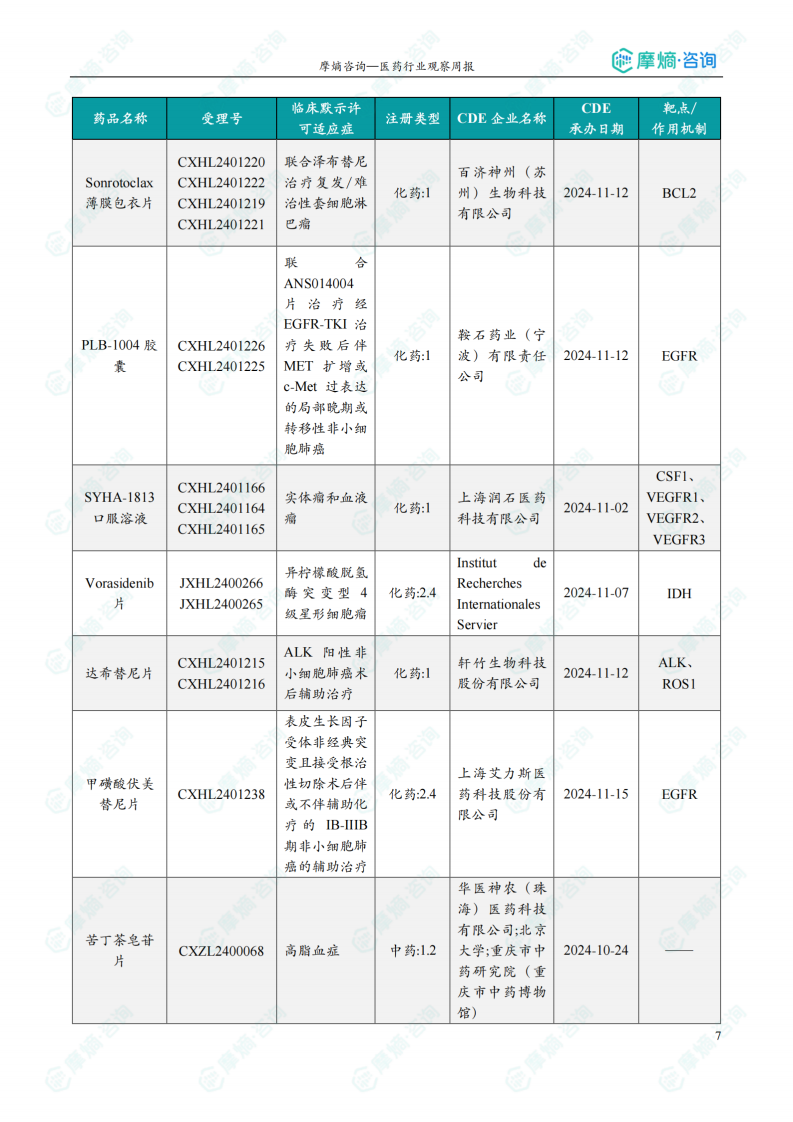
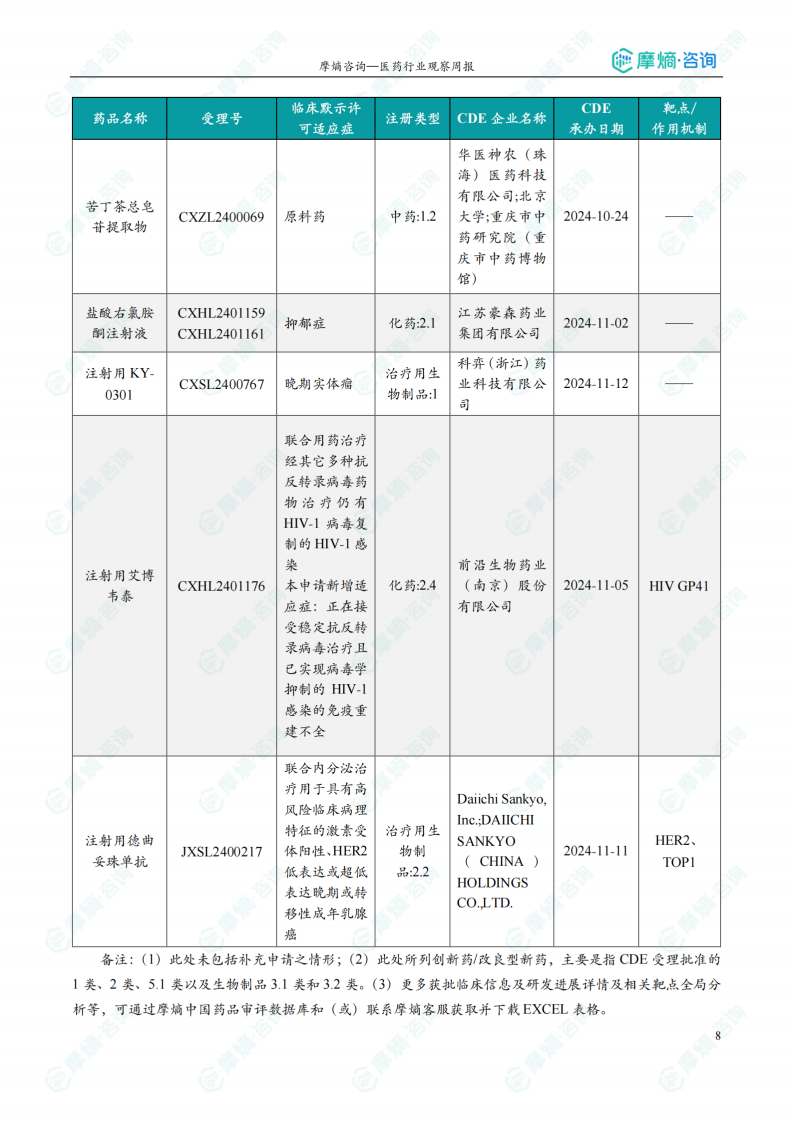
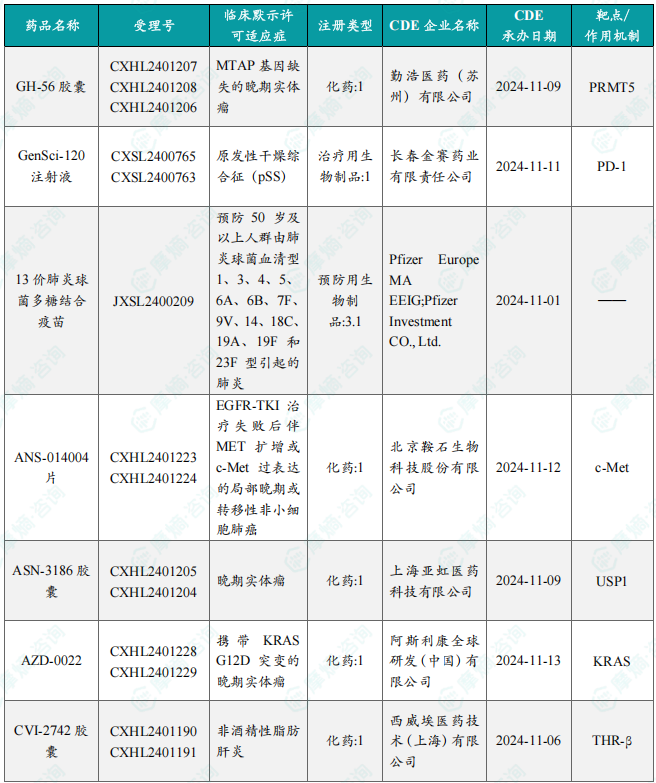
本周共计33款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药22款,生物药9款,中药2款。其中值得注意的有:
(1)CVI-2742胶囊
1月14日,CDE官网公示:西威埃医药的CVI-2742胶囊获得临床试验默示许可,用于治疗非酒精性脂肪肝炎。公开资料显示,CVI-2742胶囊是一款口服肝脏靶向THR-β选择性激动剂。研究表明,肝组织中选择性激活甲状腺激素受体-β(THR-β)可改善MASH症状,而不会引起THR-α激活介导的心脏异常。
(2)ASN-3186胶囊
1月15日,CDE官网公示:亚虹医药的ASN-3186胶囊获得临床试验默示许可,用于治疗晚期实体瘤。公开资料显示,ASN-3186胶囊是一种泛素特异性蛋白酶1(USP1)抑制剂,通过“合成致死”机制发挥抗肿瘤作用。
(3)AZD-0022
1月15日,CDE官网公示:阿斯利康的AZD-0022获得临床试验默示许可,用于治疗携带KRAS G12D突变的晚期实体瘤。公开资料显示,AZD-0022是一款小分子KRAS G12D抑制剂,KRAS是一种关键的癌基因,其突变在多种癌症(尤其是胰腺癌、结直肠癌和非小细胞肺癌)中起着驱动作用。KRAS G12D是该基因最常见的突变类型之一。
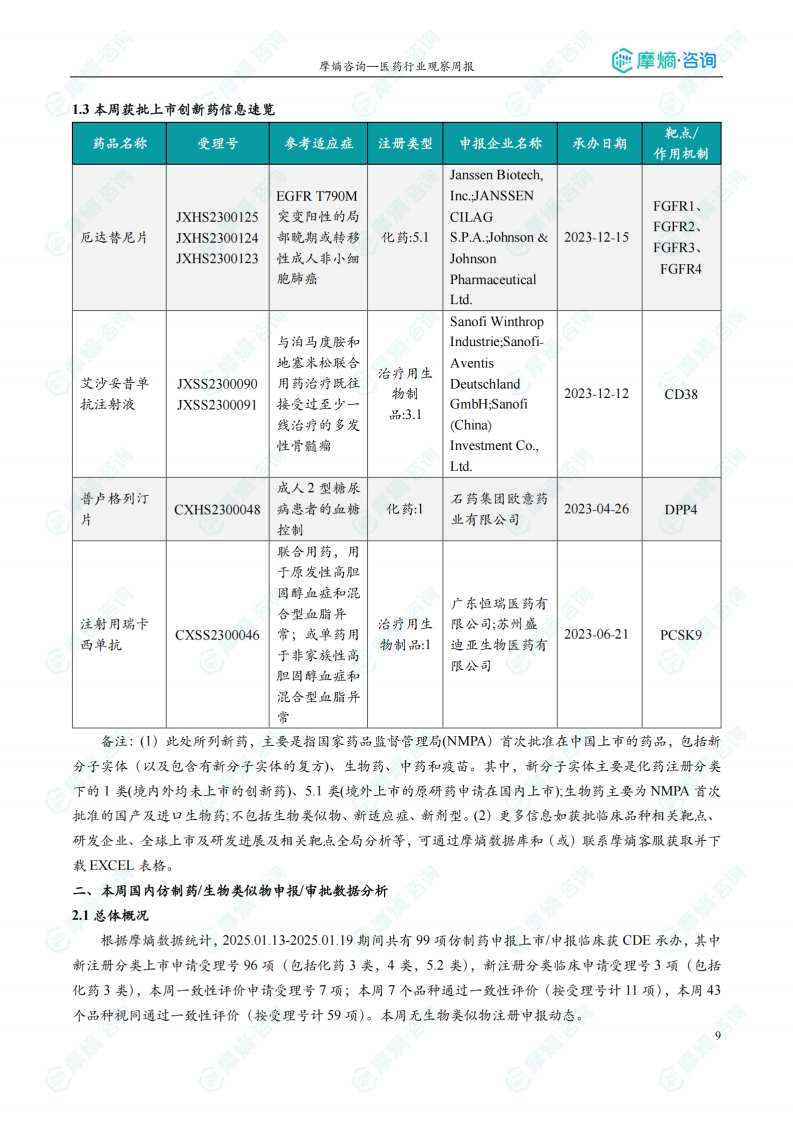
本周共4款新药获批上市,即厄达替尼片、艾沙妥昔单抗注射液、注射用瑞卡西单抗和普卢格列汀片。
本报告涉及: 相关药物:GH-56胶囊, 相关靶点:PRMT5, 相关适应症:晚期实体瘤 。
中心思想
本报告基于摩熵咨询2025年1月13日至1月19日医药行业观察周报数据,对国内外创新药、改良型新药及仿制药的研发、审批和上市情况进行统计分析,并对相关政策法规进行解读。报告核心观点如下:
国内医药市场研发态势
- 国内创新药研发持续活跃,本周多个创新药获批临床试验或上市,涵盖多个治疗领域,显示出国内医药产业的创新能力不断增强。
- 仿制药一致性评价稳步推进,本周多个品种通过或视同通过一致性评价,这将进一步优化国内药品市场结构,提高药品质量。
全球医药市场研发趋势
- 全球创新药研发竞争激烈,多个重磅药物获批上市或进入临床后期阶段,展现了全球医药产业的创新活力。
- 免疫疗法、靶向疗法等新兴疗法持续受到关注,并取得积极的临床试验结果,为多种疾病的治疗带来了新的希望。
主要内容
国内创新药/改良型新药研发及审批情况分析
国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据概览
本周(2025.01.13-2025.01.19)共有80个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办,其中国产药品60个,进口药品20个。33款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药22款,生物药9款,中药2款。4款新药获批上市,分别为厄达替尼片、艾沙妥昔单抗注射液、注射用瑞卡西单抗和普卢格列汀片。
本周重点创新药/改良型新药临床试验申请分析
报告详细介绍了CVI-2742胶囊(治疗非酒精性脂肪肝炎)、ASN-3186胶囊(治疗晚期实体瘤)和AZD-0022(治疗携带KRAS G12D突变的晚期实体瘤)等重点创新药的临床试验申请获批情况,并对这些药物的作用机制进行了简要说明。
本周重点创新药获批上市分析
报告详细分析了厄达替尼片(治疗尿路上皮癌)、艾沙妥昔单抗注射液(治疗多发性骨髓瘤)、注射用瑞卡西单抗(治疗高胆固醇血症)和普卢格列汀片(治疗2型糖尿病)等四款新药的获批上市情况,并对这些药物的适应症、作用机制和市场前景进行了分析。
国内仿制药/生物类似物申报/审批数据分析
国内仿制药/生物类似物申报审批数据概览
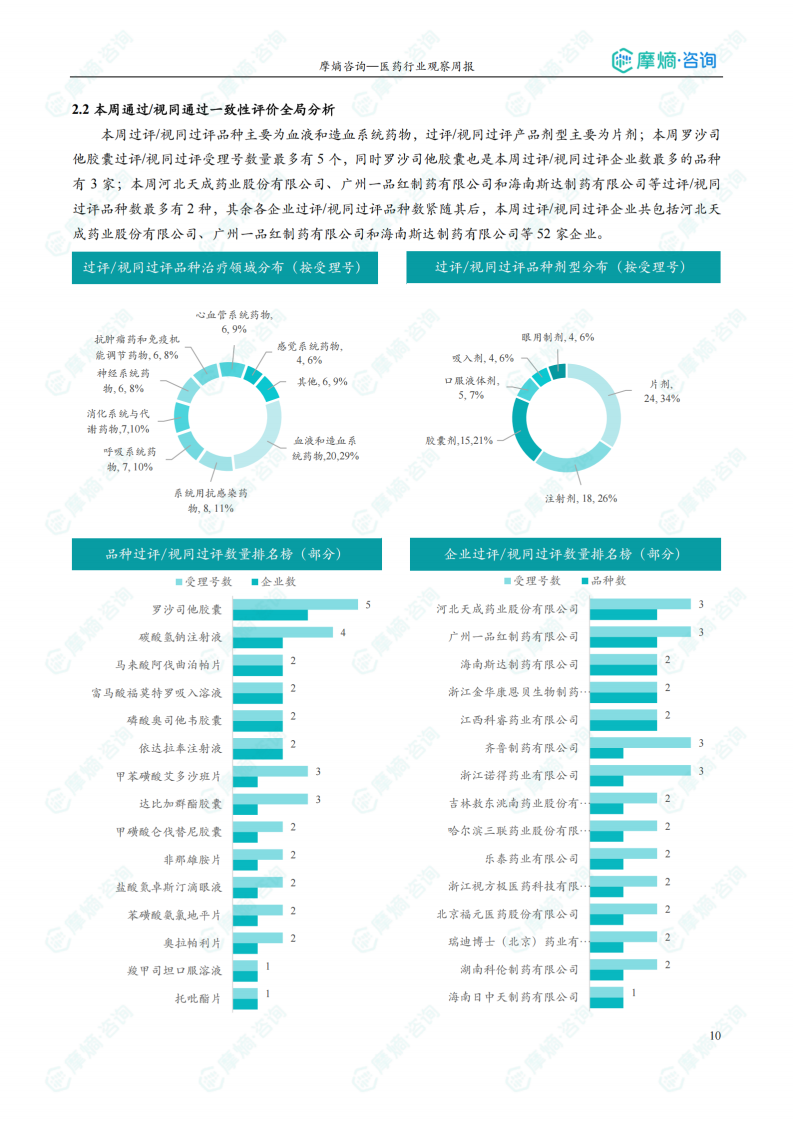
本周共有99项仿制药申报上市/申报临床获CDE承办,其中新注册分类上市申请受理号96项,新注册分类临床申请受理号3项,一致性评价申请受理号7项。7个品种通过一致性评价,43个品种视同通过一致性评价。本周无生物类似物注册申报动态。
本周一致性评价分析
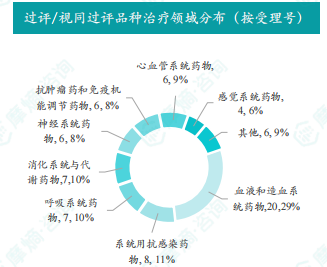
报告对本周通过/视同通过一致性评价的品种进行了全局分析,包括治疗领域分布、剂型分布以及品种和企业数量排名等,并对重点品种进行了详细介绍。 数据显示,本周过评/视同过评品种主要为血液和造血系统药物,剂型主要为片剂。罗沙司他胶囊过评/视同过评受理号数量最多。
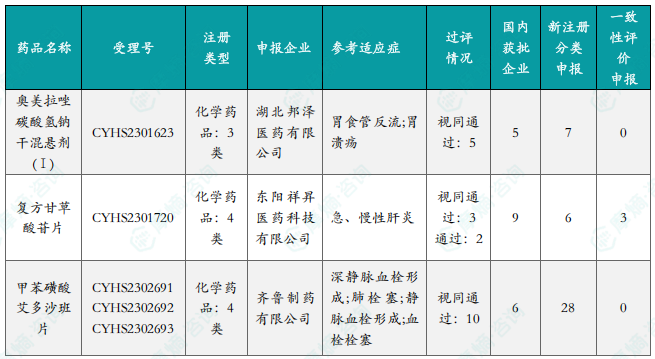
本周首次过评/视同过评品种及过评/视同过评达5家企业品种盘点
报告分别列出了本周首次通过/视同通过一致性评价的品种和通过/视同通过一致性评价企业数量达到5家的品种,并提供了相关信息,例如药品名称、受理号、申报企业、适应症等。
国内医药大健康行业政策法规汇总
本周国内医药大健康行业政策法规速览
报告列举了本周发布的与医药大健康行业相关的政策法规,包括国家药监局发布的关于脑机接口技术、细胞治疗产品生产检查指南以及医疗器械生产质量管理规范修订草案征求意见等。
本周重点行业政策详细说明
报告对《医疗器械生产质量管理规范(修订草案征求意见稿)》和《放射性治疗药物申报上市临床风险管理计划技术指导原则》两项重点政策进行了详细解读,分析了这些政策对医药行业的影响。
全球创新药研发概览
本周全球TOP10创新药研发进展
报告总结了本周全球范围内10个具有代表性的创新药研发进展,包括获批上市、新适应症获批以及申报上市等,并对这些药物的靶点、适应症、研发企业以及研发进展进行了简要介绍。
本周全球TOP10积极/失败临床结果
报告总结了本周全球范围内10个具有代表性的创新药临床试验结果,包括积极结果和失败结果,并对这些试验的药物、靶点、适应症、临床数据以及研究结果进行了简要介绍。
总结
本报告通过对国内外医药市场一周数据的分析,展现了国内外医药行业在创新药研发、仿制药一致性评价以及政策法规等方面的动态。国内创新药研发持续活跃,仿制药一致性评价稳步推进,全球创新药研发竞争激烈,新兴疗法持续涌现。 这些信息为医药企业、投资者以及监管机构提供了重要的参考依据,有助于更好地把握行业发展趋势,制定相应的战略规划。 需要注意的是,报告数据基于摩熵数据库,更详细的数据和分析可通过摩熵数据库或联系摩熵客服获取。
-

摩熵咨询医药行业观察周报(2026.01.26-2026.02.01)
-

2026年1月仿制药月报
-

2026年1月全球在研新药月报
-

摩熵咨询医药行业观察周报(2026.01.19-2026.01.25)
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 医药日报:阿斯利康Datroway获FDA优先审评资格
- 基础化工行业周报:原油、涤纶长丝价格上涨,关注地缘局势
- 医疗卫生行业:新冠肺炎全球风险评估-第9版
- 医药日报:诺华司库奇尤单抗新适应症在华获批
- 医药生物行业周报:诺华siRNA降脂药物在华获批新适应症,关注PCSK9及小核酸赛道
- 农化行业:2026年1月月度观察:钾肥合同价上涨,储能拉动磷矿需求,草铵膦将取消出口退税
- 医药日报:Lirafugratinib向FDA递交NDA
- 2025年中国生物创新药市场跟踪报告:司美格鲁肽2025年第一季度市场回顾
- 医药产业研究第9期:AlphaGenome首次揭开基因“暗物质”;中美创新药,监管比拼“全球首发”
- 医药生物行业周报:多家公司业绩预喜,创新药进入盈利兑现期
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送