-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

摩熵咨询医药行业观察周报(2025.07.28-2025.08.03)
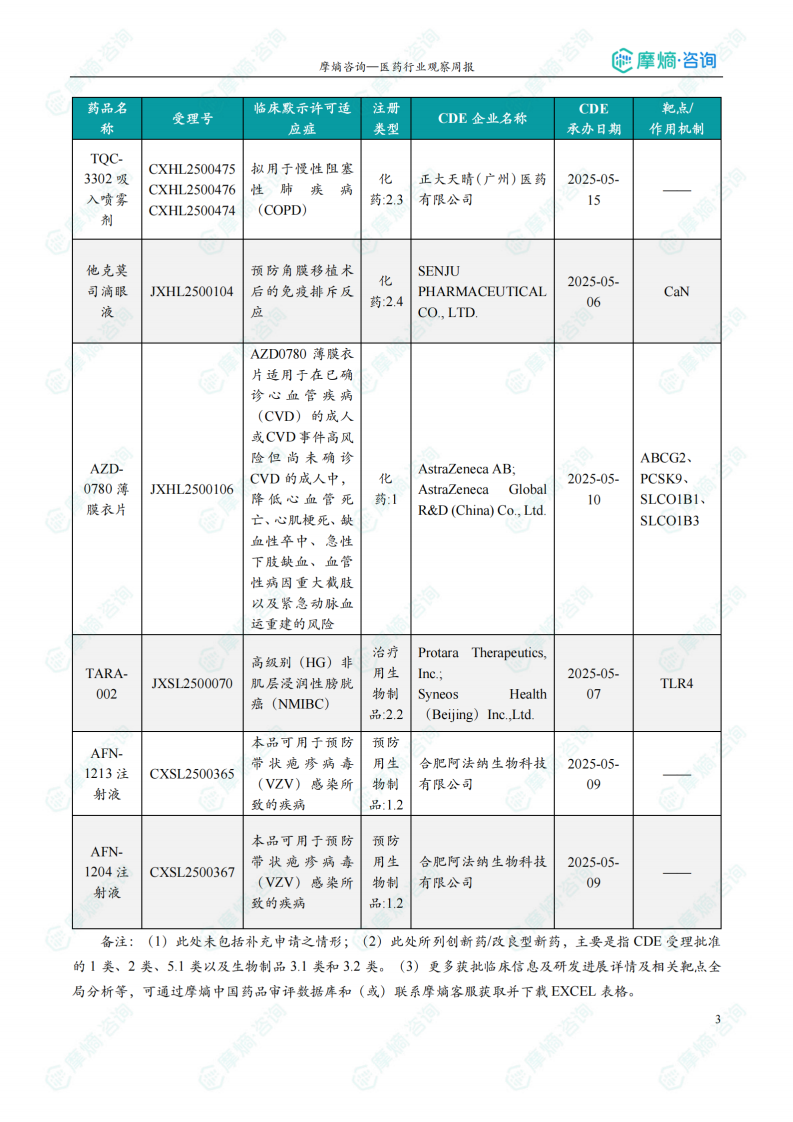
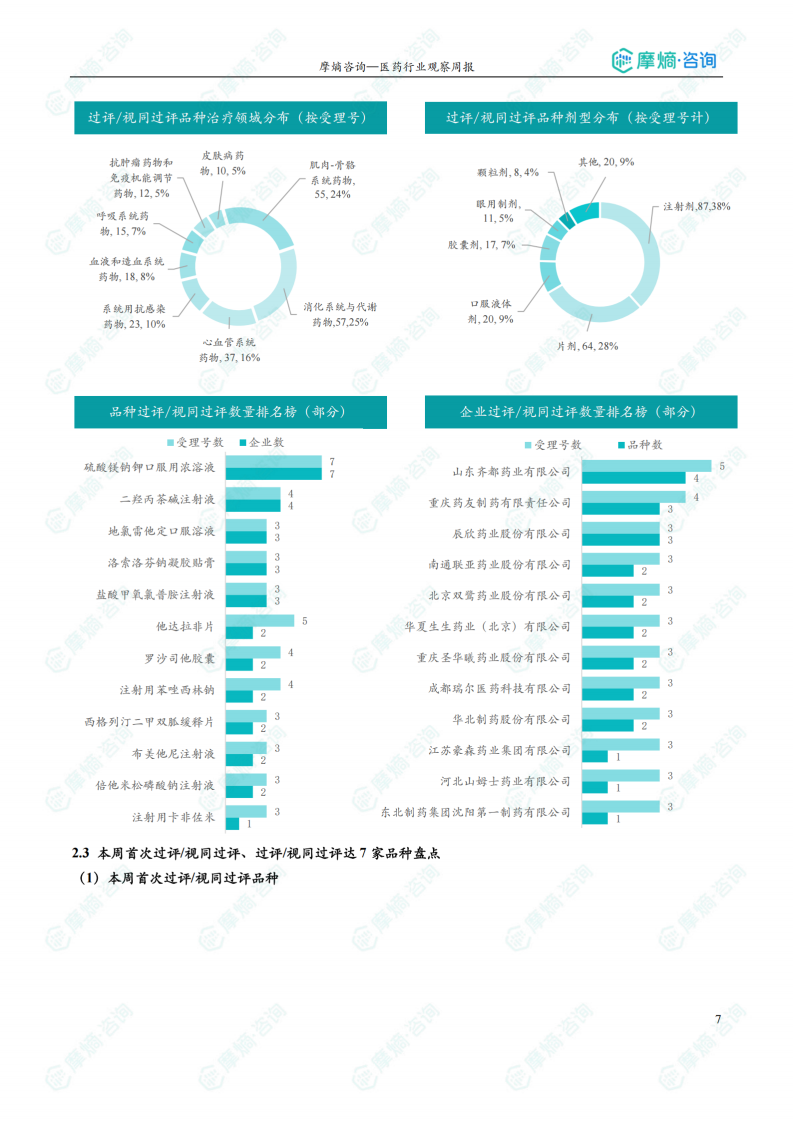
根据摩熵医药数据库统计,2025.07.28-2025.08.03期间共有103个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号80个,进口药品受理号23个。
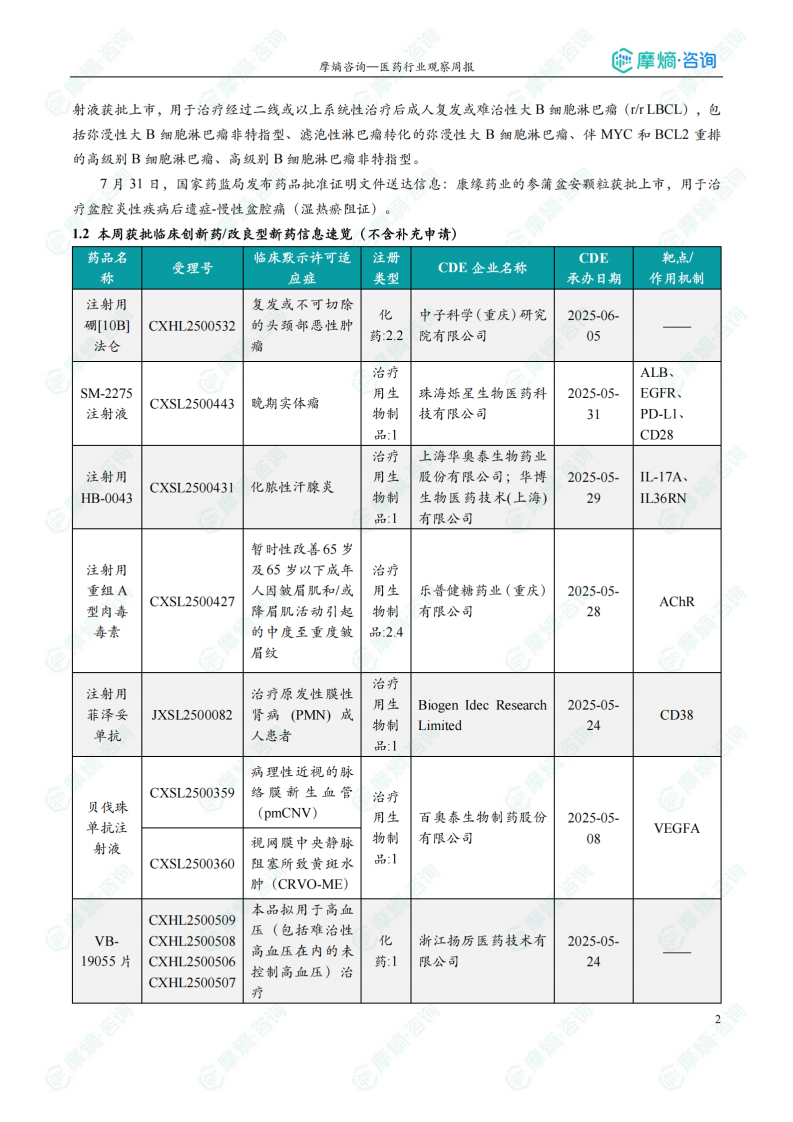
本周共计16款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药7款,生物药9款,无中药。其中值得注意的有:
(1)SM-2275注射液
7月30日,CDE官网公示:烁星生物的SM-2275注射液获得临床试验默示许可,拟用于治疗晚期实体瘤。公开资料显示,SM-2275注射液是一款基于纳米多抗技术平台开发的双靶点抗肿瘤药物,采用“双靶点阻断+条件性共刺激"的创新机制设计:同时靶向 EGFR 信号通路和 PD-L1 免疫检查点,实现对肿瘤细胞的精准打击;通过条件性激活 CD28 共刺激信号,显著增强肿瘤微环境中T细胞的免疫应答能力。
(2)注射用HB-0043
7月31日,CDE官网公示:华奥泰生物的注射用HB-0043获得临床试验默示许可,用于化脓性汗腺炎。公开资料显示,HB0043为重组人源化IgG1型双特异性抗体,同时靶向人白细胞介素-17A(IL-17A)和人白细胞介素-36受体(IL-36R),具有高结合和阻断活性,开发用于治疗多种难以治疗的自身免疫性疾病。。
(3)注射用重组A型肉毒毒素
8月1日,CDE官网公示:乐普医疗的注射用重组A型肉毒毒素获得临床试验默示许可,用于暂时性改善65岁及65岁以下成年人因皱眉肌和/或降眉肌活动引起的中度至重度皱眉纹。公开资料显示,注射用重组A型肉毒毒素的氨基酸序列与公开查询的Botox®(保妥适)和Xeomin®(思奥美)的氨基酸序列完全一致,国内目前获批上市的肉毒毒素有6款产品,衡力®是唯一国产品牌,其他均为进口产品。
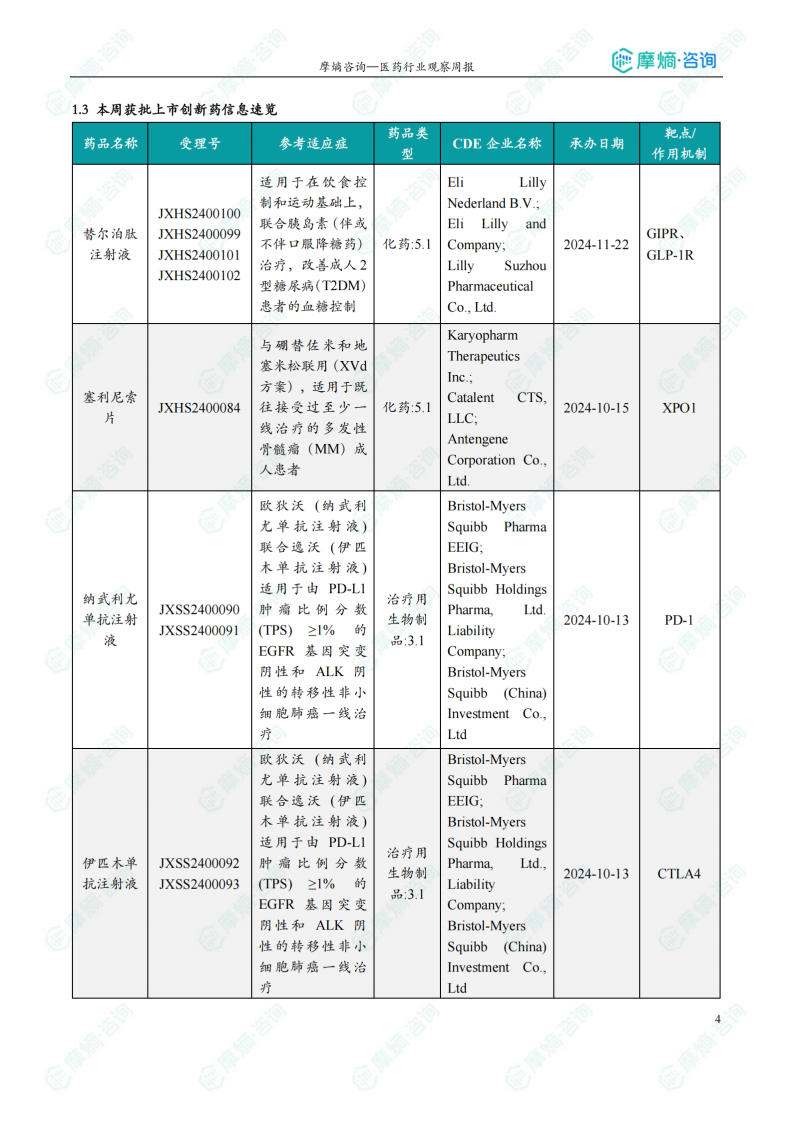
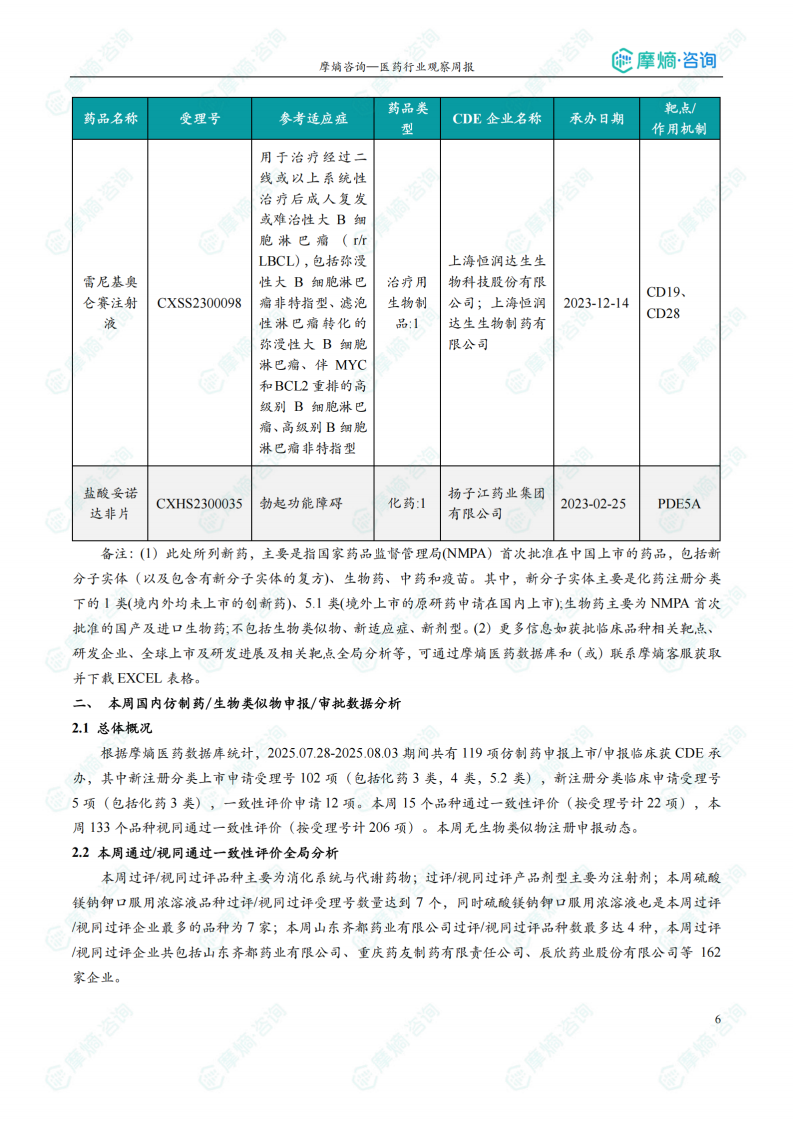
本周共10款新药获批上市,包括替尔泊肽注射液、塞利尼索片、纳武利尤单抗注射液、伊匹木单抗注射液、奥拉帕利片、瑞利珠单抗注射液、参蒲盆安颗粒、玻璃体内注射用曲安奈德、雷尼基奥仑赛注射液、盐酸妥诺达非片。
本报告涉及: 相关药物:盐酸妥诺达非片, 相关靶点:PDE5A, 相关适应症:勃起功能障碍 。



-

摩熵咨询医药行业观察周报(2026.02.09-2026.02.22)
-

摩熵咨询医药行业观察周报(2026.02.02-2026.02.08)
-

摩熵咨询医药行业观察周报(2026.01.26-2026.02.01)
-

2026年1月仿制药月报
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






相关专题报告
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送