-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

泰它西普治疗系统性红斑狼疮国内III期确证性研究达到主要临床终点,多项催化因素在即值得期待
泰它西普治疗系统性红斑狼疮国内III期确证性研究达到主要临床终点,多项催化因素在即值得期待
-
下载次数:
177 次
-
发布机构:
东亚前海证券有限责任公司
-
发布日期:
2022-09-20
-
页数:
5页
荣昌生物(688331)
事件
2022年9月19日荣昌生物宣布,泰它西普治疗系统性红斑狼疮(SLE)患者的国内Ⅲ期确证性研究达到预设主要临床终点,并获得初步数据结果。
核心观点
泰它西普治疗SLE的国内III期临床数据公布,临床获益良好,将促进泰它西普国内加速放量。确证性临床III期试验的335例患者随机分配160mg泰它西普或安慰剂,与标准治疗相结合,每周皮下注射一次。全分析集(FAS)的初步结果显示,泰它西普组的患者第52周的SRI-4反应率明显高于安慰剂组患者(82.6%对38.1%,p<0.001)。所有敏感度分析结果显示,泰它西普组的患者SRI-4反应率明显高于安慰剂组(p<0.001),并显示出良好的安全性,研究达到主要终点。国内SLE患者群体庞大,超百万,传统化学治疗药物存在反应率不足、复发风险高、副作用明显等问题,生物制剂取代化学药物是大势所趋。国内市场目前已获批用于治疗SLE的生物制剂仅有泰它西普和贝利尤单抗,非头对头的临床试验数据表明泰它西普比贝利尤单抗更具有竞争力,此次确证性临床III期试验数据的获批将支持泰它西普在国内的完全获批,促进泰它西普在国内的加速放量,进一步改善公司经营业绩。
针对SLE泰它西普具有全球“Best-in-class”竞争力,有望达成重磅交易。目前针对SLE适应症美国市场获批上市的生物制剂仅有GSK的贝利尤单抗和阿斯利康的阿尼鲁单抗。阿尼鲁单抗针对临床改进更为敏感的SRI-4临床终点指标失败,转而寻求BICLA临床终点上市,且在IFN高表达的人群中相比全人群患者并未显示出更优的SRI-4或BICLA响应率,临床疗效仍不明确,需要真实世界进一步检验。泰它西普目前在美国正在进行III期临床试验,此次公布的以SRI-4为临床终点的国内III期临床数据表现出了全球“Best-in-class”竞争力,若公司有意出售泰它西普的海外权益,考虑到该产品的竞争力和广泛适用人群,我们认为有望达成一项重磅交易。
广泛布局市场空间较大的多个自身免疫疾病,将有多项适应症数据读出。泰它西普目前布局的适应症有类风湿关节炎(RA,千万级患病人群)、视神经脊髓炎谱系疾病(NMOSD,罕见病)、原发性干燥症(SS,百亿元级市场空间)、IgA肾炎(几十亿元级市场空间)、多发性硬化症(MS,百亿美元市场空间)、全身型重症肌无力(MG,百亿元级市场空间),这些适应症大多市场空间较大但缺少有效治疗手段,泰它西普早期临床试验探索都取得了积极结果,有望满足未满足的临床需求。RA预计2022年底结束III期临床试验,有望2023年Q1申报BLA;IgA肾炎II期已做完,预计下半年进入临床III期;MGII期临床试验已完成,有望下半年公布临床数据。
投资建议
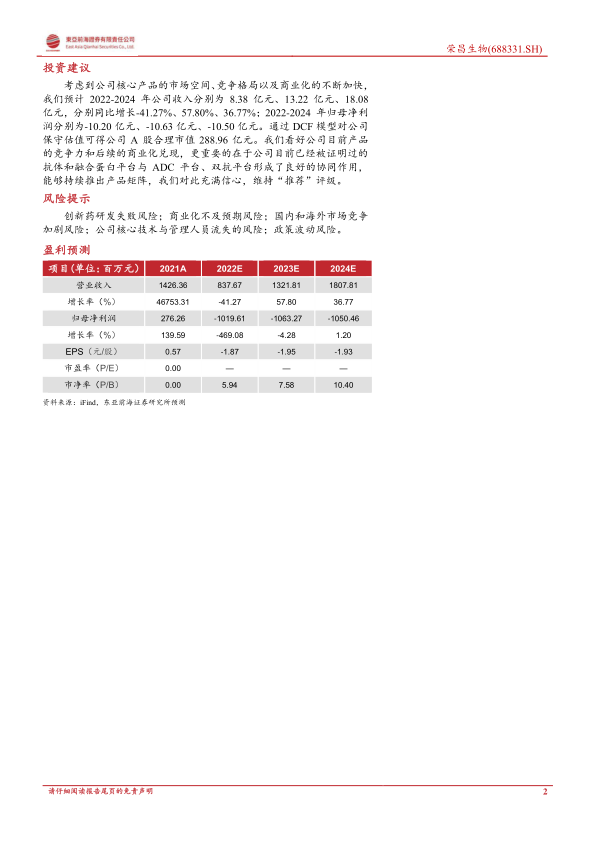
考虑到公司核心产品的市场空间、竞争格局以及商业化的不断加快,我们预计2022-2024年公司收入分别为8.38亿元、13.22亿元、18.08亿元,分别同比增长-41.27%、57.80%、36.77%;2022-2024年归母净利润分别为-10.20亿元、-10.63亿元、-10.50亿元。通过DCF模型对公司保守估值可得公司A股合理市值288.96亿元。我们看好公司目前产品的竞争力和后续的商业化兑现,更重要的在于公司目前已经被证明过的抗体和融合蛋白平台与ADC平台、双抗平台形成了良好的协同作用,能够持续推出产品矩阵,我们对此充满信心,维持“推荐”评级。
风险提示
创新药研发失败风险;商业化不及预期风险;国内和海外市场竞争加剧风险;公司核心技术与管理人员流失的风险;政策波动风险。
中心思想
泰它西普SLE III期临床突破与市场潜力
本报告核心观点指出,荣昌生物的泰它西普在治疗系统性红斑狼疮(SLE)的国内III期确证性研究中达到主要临床终点,显示出显著的临床获益和良好的安全性。这一突破性进展预计将加速泰它西普在国内市场的放量,并巩固其作为SLE治疗领域“Best-in-class”药物的全球竞争力。
多适应症布局与平台协同效应
报告强调,泰它西普不仅在SLE领域表现出色,还在类风湿关节炎(RA)、视神经脊髓炎谱系疾病(NMOSD)等多个市场空间巨大的自身免疫疾病领域进行广泛布局,并有望在未来读出多项适应症的临床数据。公司通过抗体、融合蛋白、ADC及双抗平台形成的良好协同作用,预示着其持续推出创新产品矩阵的能力,为公司长期发展提供坚实基础。
主要内容
事件回顾
- 2022年9月19日,荣昌生物宣布泰它西普治疗系统性红斑狼疮(SLE)患者的国内Ⅲ期确证性研究达到预设主要临床终点,并获得初步数据结果。
核心观点分析
泰它西普SLE国内III期临床数据积极
- 泰它西普治疗SLE的国内III期临床数据显示出良好获益,将促进其在国内加速放量。
- 在全分析集(FAS)中,泰它西普组患者第52周的SRI-4反应率显著高于安慰剂组(82.6% 对 38.1%,p<0.001)。
- 所有敏感度分析结果均显示泰它西普组的SRI-4反应率明显优于安慰剂组(p<0.001),且安全性良好。
- 国内SLE患者群体庞大,超百万,传统化疗药物存在反应率不足、复发风险高、副作用明显等问题,生物制剂替代是趋势。
- 目前国内市场已获批用于治疗SLE的生物制剂仅有泰它西普和贝利尤单抗,非头对头临床试验数据表明泰它西普更具竞争力。
全球“Best-in-class”竞争力与海外市场潜力
- 针对SLE适应症,泰它西普具有全球“Best-in-class”竞争力。
- 美国市场目前获批的生物制剂仅有GSK的贝利尤单抗和阿斯利康的阿尼鲁单抗。
- 阿尼鲁单抗在SRI-4临床终点指标上失败,转而寻求BICLA临床终点上市,且在IFN高表达人群中疗效仍不明确。
- 泰它西普目前正在美国进行III期临床试验,此次公布的国内III期临床数据表现出全球领先的竞争力。
- 若公司有意出售泰它西普的海外权益,考虑到其竞争力和广泛适用人群,有望达成重磅交易。
广泛布局自身免疫疾病管线
- 泰它西普广泛布局市场空间较大的多个自身免疫疾病,未来将有多项适应症数据读出。
- 布局适应症包括类风湿关节炎(RA,千万级患病人群)、视神经脊髓炎谱系疾病(NMOSD,罕见病)、原发性干燥症(SS,百亿元级市场空间)、IgA肾炎(几十亿元级市场空间)、多发性硬化症(MS,百亿美元市场空间)、全身型重症肌无力(MG,百亿元级市场空间)。
- 这些适应症大多市场空间大但缺乏有效治疗手段,泰它西普早期临床试验均取得积极结果。
- RA预计2022年底结束III期临床试验,有望2023年Q1申报BLA。
- IgA肾炎II期已完成,预计下半年进入临床III期。
- MG II期临床试验已完成,有望下半年公布临床数据。
投资建议与财务展望
- 考虑到公司核心产品的市场空间、竞争格局及商业化进程,维持“推荐”评级。
- 预计2022-2024年公司收入分别为8.38亿元、13.22亿元、18.08亿元,分别同比增长-41.27%、57.80%、36.77%。
- 预计2022-2024年归母净利润分别为-10.20亿元、-10.63亿元、-10.50亿元。
- 通过DCF模型保守估值,公司A股合理市值可达288.96亿元。
- 公司抗体和融合蛋白平台与ADC平台、双抗平台形成良好协同作用,能够持续推出产品矩阵。
风险提示
- 创新药研发失败风险。
- 商业化不及预期风险。
- 国内和海外市场竞争加剧风险。
- 公司核心技术与管理人员流失的风险。
- 政策波动风险。
盈利预测概览
- 营业收入: 2021A为1426.36百万元,预计2022E为837.67百万元,2023E为1321.81百万元,2024E为1807.81百万元。
- 归母净利润: 2021A为276.26百万元,预计2022E为-1019.61百万元,2023E为-1063.27百万元,2024E为-1050.46百万元。
- EPS(元/股): 2021A为0.57,预计2022E为-1.87,2023E为-1.95,2024E为-1.93。
- 资产负债率: 2021A为17.14%,预计2022E为22.84%,2023E为28.99%,2024E为46.93%。
总结
荣昌生物的泰它西普在系统性红斑狼疮(SLE)国内III期临床试验中取得显著成功,其SRI-4反应率高达82.6%,远超安慰剂组的38.1%,展现出卓越的临床疗效和安全性,有望加速在国内市场的渗透。该产品在全球范围内也具备“Best-in-class”的竞争力,为海外市场合作奠定基础。此外,公司在类风湿关节炎、IgA肾炎等多个自身免疫疾病领域拥有丰富的管线布局,多项适应症的临床进展值得期待。尽管公司短期内面临亏损,但其强大的研发平台和产品矩阵的持续推出,为未来的收入增长和市场竞争力提供了坚实支撑,维持“推荐”评级。
-

医药生物行业上市公司2022年年报及2023年一季报总结
-

化工行业22年及23年一季度业绩综述:行业整体估值处于低位,轮胎及烧碱行业业绩可期
-

光伏胶膜2022年年报及2023Q1业绩综述:需求保持高增,盈利有望修复
-

2022年年报&2023年一季报点评:投入期业绩有所扰动,关注长期经营效率提升
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 基础化工:2026年“两会”召开,重点关注“反内卷”、新质生产力、碳排放双控等议题
- 医药行业研究:靶蛋白降解:下一代颠覆性治疗范式迎来商业化元年
- 中国兽药产业全景透视:政策演进研发流程与市场格局
- 化工行业2月月报:中东局势升级
- 基础化工:天然气、甲醇等原料价格大涨,赢创调涨蛋氨酸价格
- 基础化工行业周报:地缘冲突扰动全球能化供应链,看好中国化工稳定供应全球
- 蛋氨酸行业快评:能源价格大幅推高成本,中国蛋氨酸竞争力凸显
- 医药行业周报:预期修正,关注长期价值
- 医药生物行业深度报告:投融资与出海双轮驱动,CXO迎来景气度修复与全球化新周期
- 新兴生物技术专题报告:小核酸药物方兴未艾,海外创新与国内崛起共振
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送