-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

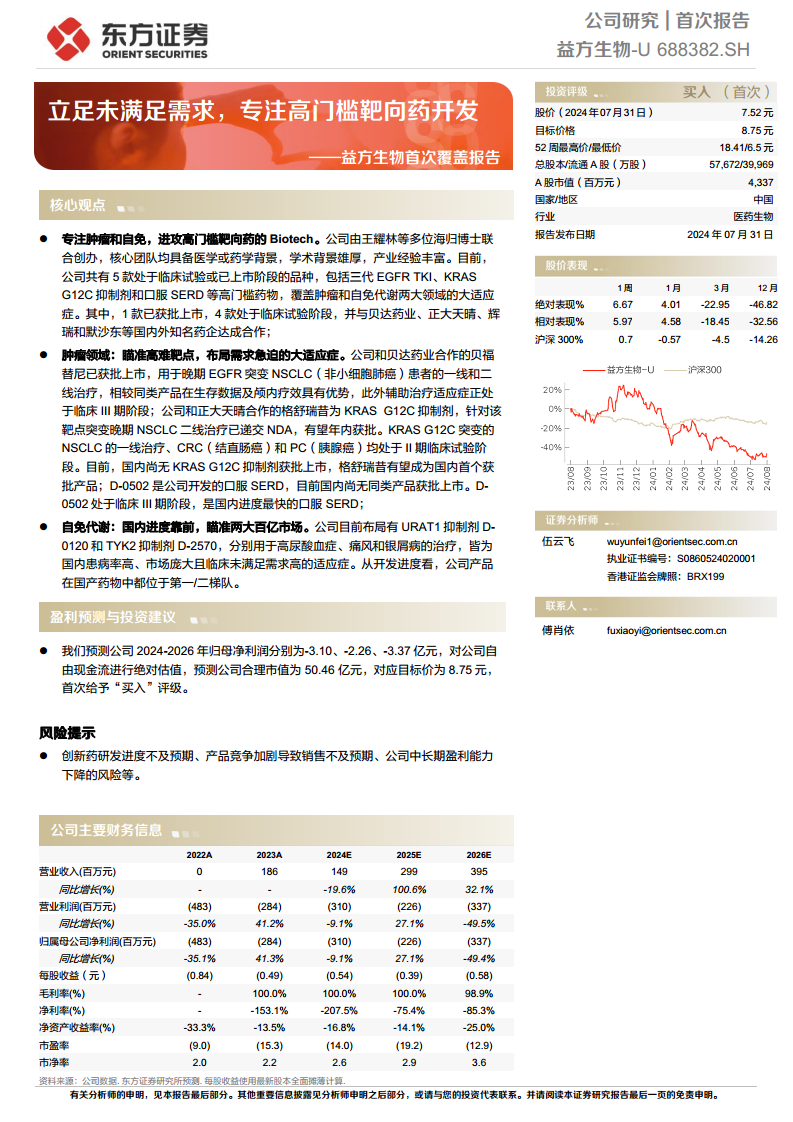
益方生物(688382)首次覆盖报告:立足未满足需求,专注高门槛靶向药开发
益方生物(688382)首次覆盖报告:立足未满足需求,专注高门槛靶向药开发
-
下载次数:
1221 次
-
发布机构:
东方证券
-
发布日期:
2024-07-31
-
页数:
34页
中心思想
创新驱动与市场聚焦:益方生物的核心竞争力
益方生物-U(688382.SH)作为一家专注于肿瘤和自免代谢领域的高门槛靶向药Biotech公司,其核心竞争力在于深厚的研发实力、经验丰富的核心团队以及高效的管线开发策略。公司致力于满足临床未被满足的需求,通过自主知识产权的创新药物,在全球范围内寻求突破。目前,公司拥有5款处于临床试验或已上市阶段的重磅产品,其中贝福替尼已获批上市,格舒瑞昔有望成为国内首款KRAS G12C抑制剂,D-0502是国内进度最快的口服SERD,D-0120和D-2570则在自免代谢领域展现出领先优势。
市场潜力与投资价值:多产品线驱动增长
益方生物的产品管线精准瞄准了肺癌、乳腺癌、高尿酸血症和银屑病等高患病率、市场规模庞大且临床需求急迫的适应症。通过与贝达药业、正大天晴、辉瑞和默沙东等国内外知名药企的合作,公司有效提升了产品的商业化潜力。尽管公司目前处于亏损状态,但基于其创新药的研发进展和市场前景,报告预测公司合理市值为50.46亿元,对应目标价8.75元,首次给予“买入”评级,认为其具备中长期盈利能力提升及估值增长的潜力。
主要内容
一、专注肿瘤和自免,进攻高门槛靶向药的Biotech
1.1 核心团队经验丰富,研发实力雄厚
益方生物成立于2013年1月,并于2022年7月在科创板上市,专注于肿瘤、自免代谢等重大疾病领域,致力于开发具有自主知识产权的创新药物。
- 团队背景: 公司由王耀林等多位海归博士联合创办,核心团队成员均具备医学或药学背景,平均拥有超过20年的跨国制药公司新药研发和团队管理经验,学术背景雄厚,产业经验丰富。
- 研发投入: 公司高度重视研发,长期保持高研发投入。截至2023年12月31日,研发人员达205人,占公司总人数的93%,其中硕士及以上学历人员占比50%,显示出高质量的研发团队构成。
1.2 管线覆盖大适应症,开发策略高效
- 产品管线: 截至2023年末,公司共有5款产品处于临床试验或已上市阶段,覆盖肿瘤和自免代谢两大领域的大适应症。其中包括1款已获批上市产品和4款处于临床试验阶段的产品。
- 高门槛药物: 产品管线涵盖第三代EGFR TKI、KRAS G12C抑制剂和口服SERD等高门槛靶向药物。
- 战略合作: 公司与贝达药业、正大天晴、辉瑞和默沙东等国内外知名药企建立了合作关系。
- 临床策略: 公司采用差异化的临床试验方案和多阶段融合的试验设计,并积极布局国际多中心临床试验,以高效加速开发进程,例如D-0502在I期试验阶段即采用单药与联合用药的多种给药方案,并在中国和美国同步开展国际多中心临床试验。
二、肿瘤领域:瞄准高难靶点,布局需求急迫的大适应症
2.1 贝福替尼:三代EGFR TKI与贝达强强联手
2.1.1 EGFR阳性NSCLC空间广阔,三代TKI稳居一线
- 肺癌负担: 2022年全球肺癌发病和死亡人数均居首位,其中非小细胞肺癌(NSCLC)占比约85%。中国NSCLC新发患者数预计将从2022年的92万人增长至2030年的106万人。
- EGFR突变: 中国新发晚期及早期复发NSCLC患者中,约40%携带EGFR突变,其中敏感突变约占85%。预计中国EGFR敏感突变NSCLC新发晚期及早期复发患者数将从2022年的24.6万人增长至2030年的27.0万人。
- 治疗进展: 晚期EGFR突变NSCLC主要以EGFR TKI治疗为主。三代TKI能有效克服一/二代TKI治疗后约50-60%患者出现的T790M耐药突变,并在一线治疗中显示出优于一代TKI的疗效和安全性。
- 市场份额: 中国已获批11款EGFR TKI(原研),其中6款为三代产品。三代TKI市场份额持续攀升,从2019年的45%增至2023年的81%。
2.1.2 贝福替尼数据亮眼,授权贝达药业商业化
- 获批情况: 贝福替尼于2023年5月获批晚期EGFR敏感突变NSCLC二线适应症,同年10月获批一线适应症,是国内第4款获批的三代EGFR TKI。
- 二线治疗优势: 在二线治疗中,贝福替尼的中位无进展生存期(mPFS)达16.6个月,中位总生存期(mOS)达31.5个月,均高于其他已获批三代TKI。在脑转移患者中,其mPFS为12.5个月,颅内客观缓解率(iORR)为57.1%,亦表现出显著优势。
- 一线治疗优势: 在一线治疗中,贝福替尼的mPFS为22.1个月,脑转移患者mPFS为19.4个月,颅内疗效数据也优于已披露的其他三代TKI。
- 适应症拓展: 贝福替尼正在开展单药用于早期EGFR敏感突变NSCLC辅助治疗的III期临床试验,以及联合贝达药业EGFR/c-MET双特异性抗体(MCLA-129)的I期临床试验,有望进一步拓展治疗版图。
- 商业化合作: 贝福替尼已授权贝达药业商业化。贝达药业在NSCLC领域深耕多年,拥有丰富的药物开发和商业化经验,其一代EGFR TKI埃克替尼累计销售额已超100亿元。此次合作有助于贝福替尼借助贝达药业强大的商业化能力实现价值最大化。
2.2 格舒瑞昔:有望成为国内首款KRAS G12C抑制剂
2.2.1 KRAS G12C突变广泛存在,有多癌种潜力
- KRAS突变: KRAS基因突变是肿瘤靶向治疗的重要靶点,广泛存在于多种肿瘤细胞,如胰腺癌(67.6%)、结直肠癌(35.8%)和非小细胞肺癌(20.4%)。
- G12C突变: KRAS G12C是NSCLC、CRC(结直肠癌)和PC(胰腺癌)等肿瘤中最常见的KRAS突变类型之一,在NSCLC中占比达41.04%。
- 市场空缺: 针对晚期KRAS G12C突变肿瘤,国内外均缺乏标准疗法,临床未满足需求巨大。目前全球仅有Amgen的索托拉西布和BMS/Mirati的阿达格拉西布两款产品获批用于二线及以后的KRAS G12C突变NSCLC,阿达格拉西布联合西妥昔单抗用于CRC。国内尚无获批药物。
- 患者规模: 预计到2030年,中国KRAS G12C突变阳性NSCLC、CRC和PC的发病人数将分别达到5.8万人、4.3万人和1.5万人。
2.2.2 开发进度领先,临床数据优于已上市产品
- 国内领先: 国内目前有3款KRAS G12C抑制剂处于上市申请(NDA)阶段,格舒瑞昔(正大天晴/益方生物)的NDA已于2023年12月获得受理,有望于今年年底或明年年初成为国内首个获批产品。
- 后线NSCLC单药数据: 在二线及以后KRAS G12C突变NSCLC患者的单药注册性II期临床试验中,格舒瑞昔的客观缓解率(ORR)达50%,中位缓解持续时间(mDoR)达12.8个月,均优于已获批的索托拉西布和阿达格拉西布。安全性方面,格舒瑞昔的停药率显著低于其他药物(0% vs 4-7%)。
- 一线NSCLC联合治疗: 格舒瑞昔联合FAK抑制剂IN10018针对KRAS G12C突变NSCLC一线治疗的Ib/II期临床数据显示,在31名可评估患者中ORR高达90.3%,高于其他KRAS G12C抑制剂披露的一线治疗数据。
- 晚期CRC联合治疗: 格舒瑞昔联用西妥昔单抗治疗晚期CRC的ORR为45%,mPFS为7.6个月,均优于已获批KRAS G12C抑制剂联用EGFR单抗的数据。3级及以上治疗相关不良事件(TRAE)发生率显著更低(12.5% vs 25-35.8%)。
- 晚期PC单药治疗: 格舒瑞昔单药治疗晚期PC的ORR为35.7%,mPFS为8.54个月,也表现出优于已获批药物的早期数据,且3级及以上TRAE发生率更低(21.4% vs 23.1-25.4%)。
- 商业化合作: 2023年8月,益方生物与正大天晴就格舒瑞昔达成合作,正大天晴在肺癌领域已上市6款产品,其强大的商业化能力将助力格舒瑞昔的销售放量。
2.3 D-0502:进度最快的国产口服SERD
2.3.1 ER阳性乳腺癌市场大,口服剂型促进SERD增长
- 乳腺癌负担: 2022年全球女性乳腺癌发病率和死亡率均居首位。中国女性乳腺癌发病率位列第二,死亡率位列第五,2022年新增35.7万例,死亡7.5万例。
- ER阳性比例: 晚期乳腺癌中,激素受体阳性(HR+)/人表皮生长因子受体2阴性(HER2-)乳腺癌占比约70%,其中绝大多数为雌激素受体阳性(ER+)。
- 标准治疗: 晚期HR+/HER2-乳腺癌的标准治疗方案主要为内分泌治疗(ET)联合细胞周期蛋白依赖性激酶4/6抑制剂(CDK4/6i)。ET包括芳香化酶抑制剂(AI)、选择性ER调节剂(SERM)和选择性ER下调剂(SERD,如氟维司群)。
- 氟维司群局限: 氟维司群因口服生物利用度低,只能肌肉注射给药,患者依从性差。此外,内分泌治疗后易出现耐药,约20%-40% AI经治患者出现ESR1突变,导致ER组成性激活,氟维司群对其敏感性显著下降。
2.3.2 口服SERD开发难度高,D-0502国内进度领先
- 开发挑战: 口服SERD的开发难度极大,曾有跨国药企(如Sanofi、罗氏)的口服SERD在临床试验中未能达到主要终点。
- 艾拉司群突破: 艾拉司群于2023年1月获FDA批准,成为全球首个也是目前唯一获批的口服SERD,用于至少一线内分泌治疗后进展的ESR1突变晚期ER+/HER2-乳腺癌患者。其III期临床试验EMERALD显示,在ESR1突变群体中mPFS达3.8个月,显著优于对照组的1.9个月。
- 竞争格局: 全球共有11款口服SERD处于临床开发阶段,其中5款处于III期。国内有4款口服SERD处于III期临床试验阶段,D-0502是进度最快的国产产品。口服SERD的治疗版图有望扩展至早期乳腺癌的辅助治疗乃至新辅助治疗。
- D-0502早期优势: D-0502单药治疗经治晚期ER+/HER2-乳腺癌患者的Ib期试验结果显示,其ORR(15.7%)、临床获益率(CBR,47.1%)以及在ESR1突变患者人群中的mPFS(10.1个月)均具有一定优势。安全性方面,D-0502的TRAE主要为胃肠道反应等常见不良事件,未出现其他竞品存在的心动过缓、视觉障碍或骨髓抑制等不良事件。
- 商业化展望: 目前D-0502暂无BD信息披露,报告假设公司将在2026年下半年获批上市后组建销售团队自主销售。
三、自免代谢:国内进度靠前,瞄准两大市场
3.1 D-0120:安全性优势突出,目标高尿酸血症百亿蓝海
- 患病人群: 高尿酸血症(HUA)已成为中国仅次于糖尿病的第二大代谢性疾病。2018-2019年,中国成人居民HUA患病率为14.0%。预计到2030年,中国HUA及痛风患者人数将达到2.8亿人。
- 治疗痛点: 目前临床常用降尿酸药物(别嘌醇、非布司他、苯溴马隆)存在安全性问题,如超敏反应、心血管风险和肝毒性。
- URAT1靶点: 尿酸盐转运体1(URAT1)是治疗HUA及痛风的 перспективный靶点,通过抑制尿酸盐重吸收促进尿酸排泄。
- D-0120优势: 全球共有17款URAT1抑制剂处于获批或临床试验阶段,D-0120目前处于中美临床II期阶段,位于国内第二梯队。IIa期数据显示,D-0120在目标剂量下患者血尿酸达标率达80%,降尿酸效果出色,且安全性良好,大多数TRAE为1/2级,无因不良反应导致的停药或死亡。
3.2 D-2570:靶向TYK2的银屑病新药,潜在治疗窗口大
- 银屑病市场: 中国银屑病患病率较高,市场规模增长迅速。预计中国银屑病药物市场规模将从2023年的43.0亿美元增长至2030年的99.4亿美元。
- 治疗现状: 中重度银屑病主要治疗方式包括生物制剂和小分子靶向药物(如磷酸二酯酶抑制剂、JAK抑制剂)。
- TYK2靶点: TYK2是JAK家族成员,主要介导IL-23、IL-12、I型IFN等细胞因子的信号传导。相比泛JAK抑制剂,TYK2抑制剂具有更高的选择性,有望带来更佳的安全性。
- D-2570潜力: 国内银屑病领域TYK2抑制剂竞争格局良好,目前仅氘可来昔替尼获批上市。D-2570处于国内II期临床试验阶段,位于第二梯队。临床前研究显示,D-2570口服生物利用度较高,且对JAK1的选择性优于氘可来昔替尼片,预计具有更大的治疗窗口。
四、盈利预测与投资建议
4.1 盈利预测
报告对
-

迈威生物(688062):商业化、BD两开花,研发快速推进
-

百洋医药(301015):2025 年三季报点评:业绩改善明显,ZAP-X国产在即
-

特宝生物(688278):2025 年三季报点评:营收高增,派格宾渗透率有望加速提升
-

泰恩康(301263):利润端承压,在研品种进展顺利
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 基础化工:2026年“两会”召开,重点关注“反内卷”、新质生产力、碳排放双控等议题
- 医药行业研究:靶蛋白降解:下一代颠覆性治疗范式迎来商业化元年
- 中国兽药产业全景透视:政策演进研发流程与市场格局
- 化工行业2月月报:中东局势升级
- 基础化工:天然气、甲醇等原料价格大涨,赢创调涨蛋氨酸价格
- 基础化工行业周报:地缘冲突扰动全球能化供应链,看好中国化工稳定供应全球
- 蛋氨酸行业快评:能源价格大幅推高成本,中国蛋氨酸竞争力凸显
- 医药行业周报:预期修正,关注长期价值
- 医药生物行业深度报告:投融资与出海双轮驱动,CXO迎来景气度修复与全球化新周期
- 新兴生物技术专题报告:小核酸药物方兴未艾,海外创新与国内崛起共振
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送