-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

康诺亚-B(02162):深度报告:深耕自免、肿瘤,IL-4R商业化领先
康诺亚-B(02162):深度报告:深耕自免、肿瘤,IL-4R商业化领先
-
下载次数:
1351 次
-
发布机构:
浙商证券
-
发布日期:
2024-12-26
-
页数:
28页
中心思想
创新药布局与商业化进展
康诺亚-B(02162)作为一家深耕自身免疫及肿瘤领域的创新药企业,已成功布局多个高潜力管线,其中核心产品IL-4Rα抗体CM310已率先实现商业化,成为国产首家获批的同类药物,并在特应性皮炎和慢性鼻窦炎伴鼻息肉等适应症上展现出领先优势。同时,其CLDN18.2 ADC药物CMG901在全球范围内进入III期临床,并获得阿斯利康的全球独家授权,彰显了国际市场对其创新价值的认可。
核心管线驱动未来增长
公司专有的nTCE双特异性抗体平台也持续验证其创新实力,多款CD3双抗药物进入临床阶段并达成重磅交易,预示着公司在ADC和双抗平台未来国际化发展上的巨大潜力。凭借领先的研发管线、丰富的商业化经验和充足的产能储备,康诺亚有望在自免和肿瘤两大高增长市场中占据重要地位,驱动公司未来业绩持续增长。
主要内容
康诺亚战略布局与商业化概况
- 管线布局与进展: 康诺亚的管线主要覆盖自身免疫及肿瘤两大领域,拥有12款处于不同研发阶段的关键候选药物,在国产同类别或同靶点药物中均处于前三位。
- 自免管线: CM310(IL-4Rα)已于2024年9月获批成人特应性皮炎(AD)适应症,2024年12月获批慢性鼻窦炎伴鼻息肉(CRSwNP)适应症,过敏性鼻炎处于NDA阶段,青少年AD及哮喘适应症已进入III期临床。CM326(TSLP)治疗CRSwNP的II期临床正在进行患者入组,CM313(CD38单抗)治疗免疫性血小板减少症(ITP)的I期临床数据良好。
- 肿瘤管线: CMG901(CLDN18.2 ADC)是全球首个获批临床的CLDN18.2 ADC产品,已获得FDA快速通道资格及国内突破性药物认定,晚期或转移性胃癌适应症于2024年3月进入III期临床。三款CD3双抗(CM355、CM336、CM350)均处于I/II期临床阶段,并已与多家药企建立战略合作关系。
- 股权结构与管理团队: 公司股权结构清晰,实际控制人兼行政总裁Bo Chen拥有超过20年的创新药物开发经验。核心高管团队在免疫肿瘤学、抗体人源化及蛋白质工程等领域经验丰富,为公司持续发展提供保障。
- 商业化能力与研发投入: 成都生产基地总计可提供18,600L生物药产能,保障后续产品商业化放量。商业化团队人数已迅速增加至190+人,并计划在2024年内组建200-300人规模的团队。2024年中报显示,公司研发投入约3.3亿人民币,同比增加33%,研发投入维持高速增长。
核心产品CM310的市场潜力与竞争优势
- 特应性皮炎(AD): CM310是国产首款获批上市的IL-4Rα抗体药物。其成人中重度AD III期临床数据显示,在第52周时,司普奇拜单抗组的EASI-75达标率为92.5%,EASI-90达标率为77.1%,每日PP-NRS评分周平均值较基线改善≥4分的应答率为67.3%。非头对头数据显示,CM310在16周时EASI-75达66.9%,优于度普利尤单抗的52.5%。度普利尤单抗2023年全球销售额突破百亿欧元(约117.17亿美元),显示IL-4Rα市场潜力巨大。
- 慢性鼻窦炎伴鼻息肉(CRSwNP): CM310于2024年12月获批此适应症,成为国内首款获批的生物制剂。II期临床数据显示,治疗16周后,双侧鼻内镜息肉评分(NPS)和鼻塞评分(NCS)较基线分别降低2.32和1.23,显著优于安慰剂组。
- 哮喘: 中国哮喘患者人数预计在2030年将达到0.78亿例,存在巨大的未满足需求。CM310已授权石药集团进行中重度哮喘和慢性阻塞性肺病(COPD)的独家开发及商业化,石药集团已于2023年6月开启II/III期患者入组。
- 过敏性鼻炎(SAR): CM310是全球首个在过敏性鼻炎III期临床成功的IL-4Rα抗体,NDA已于2024年4月获受理,预计2025年获批上市。
- 销售峰值预测: 基于对成人中重度AD、儿童青少年中重度AD、季节性过敏性鼻炎和CRSwNP等适应症的患病人数、渗透率、市占率、药物价格及年用药量等假设,CM310的总销售额峰值有望达到37.21亿元人民币。
CMG901的全球领先地位与商业化前景
- 产品特性与授权: CMG901是首个在中国及美国取得临床试验申请的CLDN18.2 ADC药物,靶向CLDN18.2,通过释放细胞毒性介质、ADCC及CDC作用杀死癌细胞。2023年2月,康诺亚与阿斯利康签署全球独家授权协议,获得6300万美元预付款和超过11亿美元的潜在里程碑付款及低双位数分层特许权使用费。
- 临床进度与竞争格局: CMG901在全球CLDN18.2靶向ADC药物中进度领先,目前已进入针对二线及以上胃癌的全球III期注册临床(2024年3月开启)。国内与信达、恒瑞等处于第一梯队,海外临床进度最快,竞争格局较好。
- 临床数据: I期临床数据显示,CMG901在治疗晚期CLDN18.2高表达胃癌/胃食管结合部腺癌受试者中表现出优秀疗效。在2.2mg/kg剂量组中,确认的ORR为48%。所有93例CLDN18.2高表达患者的mPFS为4.8个月,mOS为11.8个月,是目前唯一有mOS数据读出的CLDN18.2 ADC药物。安全性良好,与药物相关的≥3级治疗期不良事件发生率为55%。
- 销售峰值预测: 基于对国内及欧美胃癌患者数、二线治疗率、CLDN18.2 ADC药物渗透率、CMG901市占率及年治疗费用等假设,CMG901归属康诺亚的总收入峰值有望达到15.75亿元人民币(不含首付款及里程碑)。
双抗平台的技术价值与BD合作
- nTCE双特异性抗体平台: 康诺亚专有的nTCE双特异性抗体平台已开发出三款进入临床试验阶段的候选药物:CM355(CD20xCD3)、CM336(BCMAxCD3)和CM350(GPC3xCD3)。该平台旨在增强T细胞介导的肿瘤消灭并最小化细胞因子释放综合症风险。
- CM355(CD20xCD3): 与诺诚健华合作开发,用于治疗复发/难治性非霍奇金淋巴瘤(NHL)。I/II期临床试验中,15名接受CM355(剂量≥6毫克)治疗的患者ORR均达到100%,SC组别的可评估患者中ORR达到100%,完全缓解率(CRR)达到63.6%。
- CM336(BCMAxCD3): 治疗多发性骨髓瘤的BCMAxCD3双特异性抗体。ASH会议公布的I/II期临床结果显示,52%的受试者达到sCR或CR,MRD阴性率为95%,且安全性及耐受性良好。2024年11月,康诺亚与Platina Medicines Ltd(PML)达成独家许可协议,授予其在大中华区外开发、生产及商业化CM336的独家权利,获得1600万美元首付款和近期付款,以及潜在的6.1亿美元里程碑付款和分层特许权使用费,充分验证了nTCE平台的创新研发能力。
- CM350(GPC3xCD3): 前瞻布局肝细胞癌(HCC)新靶点GPC3,目前处于I/II期临床研究的剂量递增阶段。GPC3在HCC中高表达,CM350临床进度领先,为国内首家、全球第二家布局GPC3xCD3靶点的双抗。
财务预测与投资估值
- 收入预测: 预计2024-2026年公司营业收入分别为3.49亿元、5.05亿元和11.02亿元,毛利率分别为83.36%、80.00%和85.21%。其中,创新药核心产品销售额预计分别为0.77亿元、5.05亿元和10.56亿元;海外授权、里程碑付款和销售分成收入预计分别为2.72亿元、0亿元和0.46亿元。
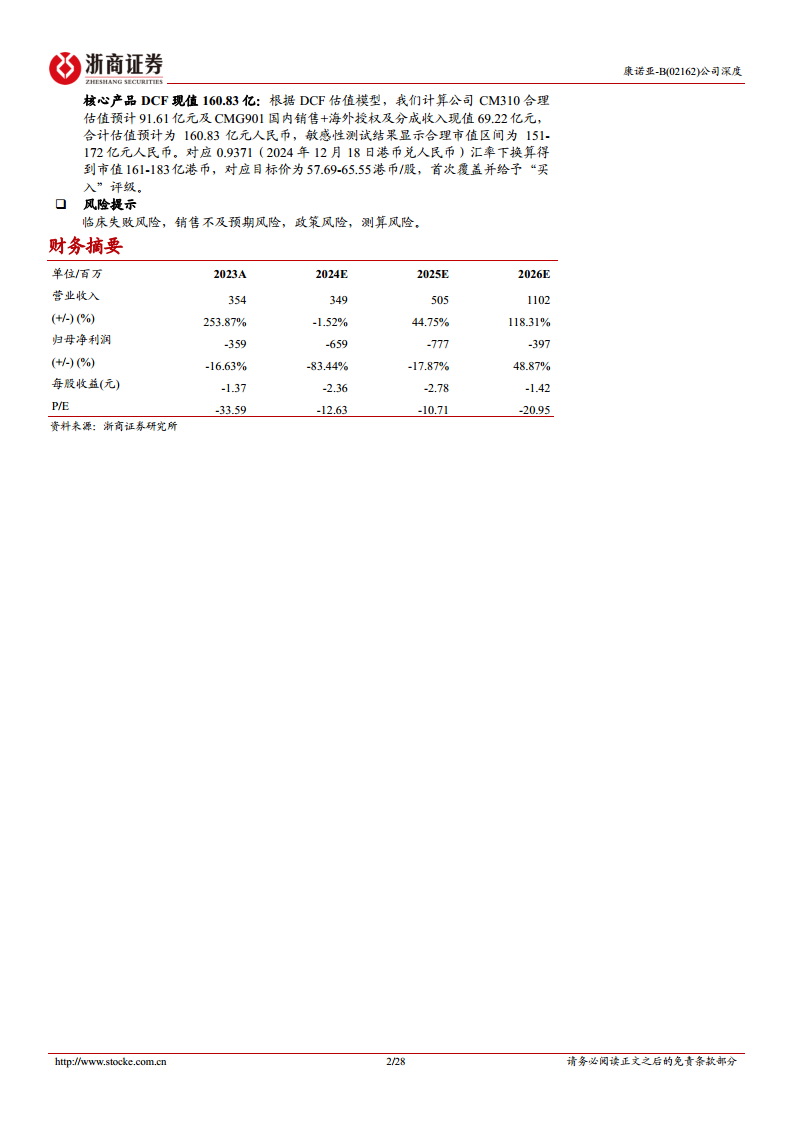
- 绝对估值: 采用DCF估值模型,计算公司CM310合理估值预计为91.61亿元人民币,CMG901国内销售+海外授权及分成收入现值预计为69.22亿元人民币。合计估值预计为160.83亿元人民币,敏感性测试结果显示合理市值区间为151-172亿元人民币。对应0.9371的汇率下,市值约为161-183亿港币,对应目标价为57.69-65.55港币/股。
- 投资评级: 首次覆盖并给予“买入”评级。
- 风险提示: 临床失败风险、产品销售不及预期风险、政策风险(如医保谈判降价)、测算风险。
总结
康诺亚-B作为一家专注于自身免疫和肿瘤领域的创新药企业,凭借其在IL-4Rα、CLDN18.2和CD3等多个高潜力靶点上的深度布局,展现出强大的研发实力和商业化前景。核心产品CM310已成功商业化,并在多个适应症上取得领先进展,市场潜力巨大。CMG901作为全球领先的CLDN18.2 ADC,通过与阿斯利康的合作,其国际化发展潜力得到显著提升。此外,公司专有的nTCE双抗平台也通过多项重磅交易验证了其技术价值。尽管面临临床失败、销售不及预期和政策变化等风险,但基于对核心产品销售额的预测和DCF估值模型,康诺亚的合理估值预计为160.83亿元人民币,具备显著的投资价值。
-

迈瑞医疗(300760):2025年三季报点评报告:收入同比回正,看好业绩修复
-

百诚医药(301096):2025年三季报点评报告:主业或见底,看好创新转型
-

晨光生物(300138):棉籽与植提业务盈利齐升,经营态势持续向好
-

登康口腔(001328):2025Q3业绩点评报告:主动收缩投入致线上降速,关注后续投入恢复
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 基础化工:2026年“两会”召开,重点关注“反内卷”、新质生产力、碳排放双控等议题
- 医药行业研究:靶蛋白降解:下一代颠覆性治疗范式迎来商业化元年
- 中国兽药产业全景透视:政策演进研发流程与市场格局
- 化工行业2月月报:中东局势升级
- 基础化工:天然气、甲醇等原料价格大涨,赢创调涨蛋氨酸价格
- 基础化工行业周报:地缘冲突扰动全球能化供应链,看好中国化工稳定供应全球
- 蛋氨酸行业快评:能源价格大幅推高成本,中国蛋氨酸竞争力凸显
- 医药行业周报:预期修正,关注长期价值
- 医药生物行业深度报告:投融资与出海双轮驱动,CXO迎来景气度修复与全球化新周期
- 新兴生物技术专题报告:小核酸药物方兴未艾,海外创新与国内崛起共振
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送