-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

大消费北交所上市公司系列研究之诺思兰德:深耕基因治疗领域的创新型生物制药企业
大消费北交所上市公司系列研究之诺思兰德:深耕基因治疗领域的创新型生物制药企业
-
下载次数:
475 次
-
发布机构:
东莞证券股份有限公司
-
发布日期:
2022-04-19
-
页数:
23页
诺思兰德(430047)
公司是一家深耕基因治疗领域的创新型生物制药企业。 公司成立于2004年6月, 2021年11月在北京证券交易所首批上市。公司建立了基因载体构建、工程菌构建、微生物表达、哺乳动物细胞表达、生物制剂生产工艺及其规模化生产技术以及滴眼剂药物开发等核心技术平台,为持续开发项目提供了保障。公司坚持以临床需求为导向,依托自主核心技术平台,主要致力于心血管疾病、代谢性疾病、罕见病和眼科疾病等领域生物工程新药的研发和产业化。
基因治疗概念热度渐起,行业加速发展。 基因治疗是一种利用基因治疗载体将外源的治疗性基因转导至细胞,再通过外源基因的转录和翻译,改变细胞原有基因表达以治疗疾病的方法。 2016年-2020年, 国内基因治疗市场规模从1500万元增长到2380万元,增长幅度尚不明显。国家和各级政府持续出台产业鼓励政策,支持基因治疗CDMO及基因治疗整体产业的发展。 随着基因治疗临床试验的大量开展、 基因治疗产品的陆续预期获批上市、相关利好产业政策的支持,预计国内基因治疗市场规模将快速扩大,到2025年将达到178.9亿元。
公司重点在研产品NL003未来有望成为重磅产品。 NL003主要开发适应症为严重下肢缺血性疾病( Critical limb ischemia, CLI),包括静息痛、溃疡患者、间歇性跛行的下肢缺血性疾病适应症。我国严重下肢缺血性疾病的患病人数不断增加,针对CLI患者现有的治疗手段未满足医疗需求,急需新的治疗手段。 NL003治疗CLI的临床II期试验结果显示,对CLI的疼痛和溃疡具有良好改善作用,首次给药第60天至180天,所有NL003给药组对比安慰剂组均能显著缓解疼痛,第180天后在不服用镇痛药物前提下静息痛完全消失率可达56.25%,溃疡完全愈合率可达66.67%,均显著高于安慰剂组。 NL003和其他治疗CLI手段相比,具有多项优势,有望从基因层面治疗CLI。
风险提示: 研发失败风险; 产品注册风险; 市场竞争风险; 公司在未来一定期间可能无法盈利或无法进行利润分配的风险等
中心思想
创新基因治疗企业的市场定位与核心竞争力
诺思兰德(430047)作为一家深耕基因治疗领域的创新型生物制药企业,凭借其在基因载体构建、生物制剂生产工艺及滴眼剂药物开发等方面的核心技术平台,确立了在心血管疾病、代谢性疾病、罕见病和眼科疾病等生物工程新药研发与产业化方面的市场定位。公司拥有丰富的研发管线,其中核心在研产品NL003在严重下肢缺血性疾病(CLI)治疗上展现出显著的临床优势和巨大的市场潜力,有望成为未来的重磅产品。
基因治疗市场前景广阔及核心产品NL003的潜力
基因治疗作为新兴的精准医疗手段,在全球及中国市场均呈现加速发展的态势。全球基因治疗市场规模预计将从2020年的20.8亿美元增长至2025年的近305.4亿美元,而中国市场同期也将从2380万元迅速扩大至178.9亿元。在政策支持和临床试验大量开展的背景下,诺思兰德的NL003产品,针对未被满足的CLI治疗需求,其II期临床试验结果显示出良好的疼痛缓解和溃疡愈合效果,且具备多项治疗优势,预计将于2022年申报上市,有望抓住行业发展机遇,成为公司未来业绩增长的核心驱动力。
主要内容
1、公司是从事生物新药研发的创新型生物制药企业
1.1 公司概况
诺思兰德成立于2004年6月,并于2021年11月在北京证券交易所首批上市,是一家专注于基因治疗药物、重组蛋白质类药物和眼科用药物研发、生产及销售的创新型生物制药企业。公司拥有一支高素质的研发及管理团队,在药物研发的各个阶段积累了丰富经验。其核心技术平台涵盖基因载体构建、工程菌构建、微生物表达、哺乳动物细胞表达、生物制剂生产工艺及其规模化生产技术,以及滴眼剂药物开发。公司坚持以临床需求为导向,致力于心血管疾病、代谢性疾病、罕见病和眼科疾病等领域的生物工程新药研发与产业化。
公司积极开展外部合作,例如在2012年与韩国Huons合资成立北京汇恩兰德制药有限公司,引进了先进的BFS系统,专业生产高品质滴眼液,年产能达1.1亿支,并提供CMO/CDMO服务。诺思兰德获得了多项荣誉,包括国家火炬计划重点高新技术企业、北京市“专精特新”中小企业等。公司研发管线丰富,目前在研13个生物工程新药对应15个适应症,其中重组人肝细胞生长因子裸质粒注射液(NL003)和注射用重组人白细胞介素11(NL002)已进入Ⅲ期临床,注射用重组人胸腺素β4(NL005)正在开展Ⅱ期临床研究。公司拥有23项授权专利,并承担了8项国家级“重大新药创制”课题。截至2021年三季度末,公司创始人团队持股比例较高,其中许松山先生和许日山先生合计持有公司25.61%的股份,为公司实际控制人。
1.2 公司是一家深耕基因治疗领域的创新型生物制药企业
诺思兰德作为创新型生物制药企业,深耕生物医药行业十七载,形成了具有行业特色的基因治疗和重组蛋白质类药物产品管线,并建立了领先的生物工程新药研发和生产技术平台,包括基因筛选与工程菌构建、裸质粒基因治疗药物、微生物表达重组蛋白质药物、哺乳动物细胞表达重组蛋白质药物、滴眼剂药物以及生物技术药物工艺放大和规模化生产平台。
1.2.1 基因治疗药物
公司在研基因治疗药物管线包括6个新药,对应8个适应症。其中,核心研发项目NL003(重组人肝细胞生长因子裸质粒注射液)主要适应症为严重下肢缺血性疾病(CLI),目前处于III期临床研究阶段。此外,还有1项基因治疗药物处于I期临床研究阶段,其余多个创新项目处于临床前研究阶段,适应症覆盖下肢缺血性疾病、绝经后妇女骨质疏松症、2型糖尿病等多个治疗领域。
1.2.2 重组蛋白质类药物
公司在研重组蛋白质类药物管线包括6个新药,对应6个适应症。其中,1项处于III期临床研究阶段,1项处于II期临床研究阶段,其余多个创新项目处于临床前研究阶段。这些药物的适应症覆盖急性心肌梗死所致缺血再灌注损伤、急性肺损伤和急性呼吸窘迫综合征、肿瘤化疗导致的血小板减少症、甲型血友病和干眼症等多个治疗领域,显示出公司在心血管疾病等治疗领域的重要突破。
1.2.3 滴眼液产品(化学仿制药)
公司现阶段主要研发和生产抗菌、抗过敏、干眼症和抗青光眼等适应症的滴眼液仿制药。公司已通过2条滴眼液生产线GMP认证/检查,并已上市销售“酒石酸溴莫尼定滴眼液”、“玻璃酸钠滴眼液”和“盐酸奥洛他定滴眼液”3个品种。另有“平衡盐溶液(供灌注用)”待批。这些产品在作用机制上具有各自的特点,例如酒石酸溴莫尼定通过双重机制降低眼内压并具有视网膜神经节细胞保护作用;盐酸奥洛他定作为新型组胺H1受体选择性拮抗剂,具有稳定肥大细胞、抑制组胺释放的双效抗过敏作用。
1.3 滴眼液产品是公司现阶段营收来源,核心产品处于在研状态
作为一家创新型生物制药企业,诺思兰德的核心产品目前仍处于在研状态,尚未贡献营收。公司现阶段的营收主要来源于已上市销售的滴眼液产品,包括“酒石酸溴莫尼定滴眼液”、“玻璃酸钠滴眼液”和“盐酸奥洛他定滴眼液”。由于持续的研发投入,公司近年来仍处于亏损状态。
为拓展市场,公司与欧康维视和青松医药集团签订了滴眼液产品销售总代理合同,使得酒石酸溴莫尼定滴眼液和玻璃酸钠滴眼液的销售额同比大幅增长。盐酸奥洛他定滴眼液在2月第四批国家药品带量集中采购中中标,销售区域覆盖北京、天津等15个省市。此外,公司还顺利完成了4个项目的委托加工协议。2021年前三季度,公司实现营业收入3535.53万元,其中2021上半年眼药水药品销售收入为2197.45万元,代加工费用收入为84.7万元。
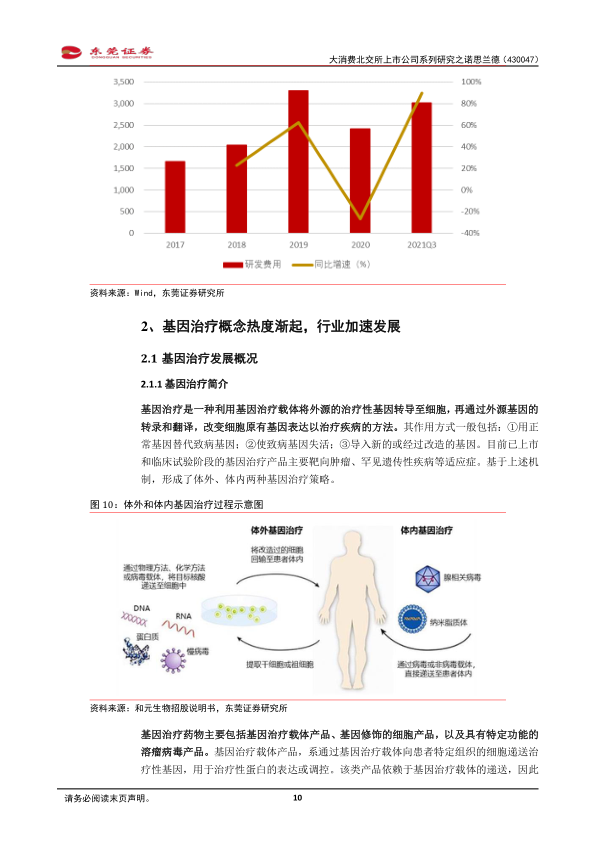
公司持续加大研发投入,2021年前三季度研发费用达3021.26万元,同比增长89.74%。尽管2020年受疫情及临床试验入选标准严苛影响,研发费用有所下降,但公司整体研发投入保持高速增长。核心在研项目NL003已累计启动18家研究中心开展临床研究,并积极采取措施加快入组。NL005项目治疗心肌梗死所致缺血再灌注损伤(MIRI)适应症的Ⅱa期临床研究在6家中心顺利开展。同时,Y002、Y003、Y004、Y005等新项目也在稳步推进。眼科仿制药方面,公司围绕地夸磷索钠滴眼液、玻璃酸钠滴眼液、酒石酸溴莫尼定滴眼液等品种开展了方法学、稳定性及相容性研究,并编写了注册申报资料。
2、基因治疗概念热度渐起,行业加速发展
2.1 基因治疗发展概况
2.1.1 基因治疗简介
基因治疗是一种通过基因治疗载体将外源治疗性基因转导至细胞,进而改变细胞原有基因表达以治疗疾病的方法。其作用机制主要包括替代致病基因、使致病基因失活或导入新的/改造的基因。目前已上市和临床试验阶段的基因治疗产品主要靶向肿瘤、罕见遗传性疾病等适应症,并形成了体外和体内两种基因治疗策略。基因治疗药物主要分为基因治疗载体产品(通过载体递送治疗性基因)、基因修饰的细胞产品(如CAR-T细胞疗法,通过基因编辑或慢病毒修饰T细胞以杀伤肿瘤细胞)以及溶瘤病毒产品(利用溶瘤病毒对肿瘤细胞的特异性识别和免疫激活作用进行靶向杀伤)。
2.1.2 基因治疗发展历程
基因治疗的发展与分子生物学、基因组学、基因编辑技术等基础科学的进步紧密相关。自1953年DNA双螺旋结构模型提出以来,相关理论和技术取得了巨大进步。1972年,Friedmann和Roblin首次提出基因治疗概念。2003年,全球首个基因治疗药物重组人p53腺病毒注射液(今又生/Gendicine)在中国获批。2005年,溶瘤病毒治疗产品安柯瑞(Oncorine)在中国获批上市,成为全球首个获批的溶瘤病毒药物。2012年,基于AAV的基因治疗药物Glybera获EMA批准。2015年,Amgen公司的黑色素瘤治疗药物Imlygic成为FDA和EMA批准的首款溶瘤病毒治疗产品。2017年,美国Spark Therapeutics的基因疗法Luxturna获批上市,成为FDA批准的首款基于AAV的基因疗法;同年,诺华的Kymriah成为全球首个获FDA批准的CAR-T产品。此后,Yescarta、Tecartus、Breyanzi、Abecma等多款CAR-T药物相继获FDA批准。中国NMPA也于2021年6月和9月分别批准了首款CAR-T产品奕凯达®和首个1类新药CAR-T产品倍诺达®。
美国基因治疗行业监管体系经历了自由发展阶段(1991-1999)、调整阶段(1999年因患者死亡引发安全讨论)和规范化发展阶段(1999年至今,FDA陆续公布多项监管办法,加强受试者保护,并于2018年简化监管程序),形成了严谨完善的监管框架。
中国基因治疗行业监管起步晚于美国,但发展路径相似,逐步走向体系化、规范化。经历了自由发展阶段(1993-2015年,政策涉及临床试验、质控、伦理审查,但缺乏全面框架,2015年取消第三类医疗技术临床应用准入的非行政许可审批促进了发展)、调整阶段(2016年因医疗事故暂停未经批准的第三类医疗技术临床应用,免疫治疗技术仅限临床研究)和规范化发展阶段(2016年至今,基因治疗被列为国家重点发展前沿领域,国务院发布“十三五”规划,NMPA于2017年发布《细胞治疗产品研究与评价技术指导原则(试行)》,大幅提高产业门槛和监管力度,2020年政府出台多项监管政策促使行业进一步规范化)。
2.2 基因治疗市场规模及前景
2.2.1 全球基因治疗市场规模及前景
自2015年以来,全球基因治疗行业进入高速发展期,得益于基础生命科学和前沿生物科技的进步。以基因疗法为代表的精准医疗快速兴起,对传统小分子和大分子药物市场起到了重要的补充、迭代和开拓作用。近年来,部分重要的基因治疗药物已被纳入美国、英国、日本等多个发达国家的医保体系。全球基因治疗市场规模从2016年的5040万美元增长到2020年的20.8亿美元,预计到2025年将达到近305.4亿美元。
2.2.2 中国基因治疗市场规模及前景
中国基因治疗市场规模预计将快速扩大。2016年至2020年,国内基因治疗市场规模从1500万元增长到2380万元,增长幅度尚不明显。然而,随着基因治疗临床试验的大量开展、基因治疗产品的陆续预期获批上市以及相关利好产业政策的支持,预计国内基因治疗市场规模将快速扩大,到2025年将达到178.9亿元。
2.2.3 中国已上市基因治疗药物情况
中国已有2款CAR-T产品获批上市。复星凯特的CAR-T产品——奕凯达®(阿基仑赛注射
-

医药生物行业双周报:脑机接口板块表现靓眼
-

现代煤化工行业专题报告:契合国家战略,产业集聚发展
-

基础化工行业双周报:《煤炭清洁高效利用重点领域标杆水平和基准水平(2025年版)》发布
-

深度报告:全国性高值医疗器械流通商
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 2025年中国可穿戴医疗设备行业市场研究报告
- 2025年中国母婴医疗服务行业市场研究报告
- 医药日报:Enliven在研新药ELVN-001一期临床成功
- 基础化工行业周报:对日二氯二氢硅反倾销调查启动,中石化与中航油实施重组
- 基础化工行业周报:原油、丁二烯价格上涨,关注电子特气
- 化工行业报告:化工板块维持景气度,锰酸锂、电解液(磷酸铁锂)、碳酸锂、二乙二醇、NCM等产品涨幅居前
- 化工行业研究:丁二烯、丙烯腈等涨幅居前,建议关注进口替代、纯内需、高股息等方向
- 中国成人癌痛治疗药物行业调研简报|2025/10:国产新药迈入临床,癌痛治疗开辟新路径
- 医疗器械行业快评报告:八部门印发《“人工智能+制造”专项行动实施意见》,加快脑机接口产业化商业化进程
- 数字经济双周报(2026年第1期):前瞻布局未来产业:脑机接口量产与商业化提速
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送