-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

微芯生物:原创新药多适应症拓展,有望开启国际化新征程
微芯生物:原创新药多适应症拓展,有望开启国际化新征程
-
下载次数:
164 次
-
发布机构:
太平洋证券股份有限公司
-
发布日期:
2024-07-23
-
页数:
38页
微芯生物(688321)
报告摘要
西达本胺新增DLBCL和mCRC适应症有望达33.8亿峰值
(1)DLBCL适应症销售峰值有望达11.7亿元
2024年4月30日,微芯生物公告西达本胺联合R-CHOP方案用于MYC和BCL2表达阳性的既往未经治疗的弥漫大B细胞淋巴瘤(DLBCL)患者适应症获批上市,患者人群预计占整体DLBCL患者的50%-60%。根据GLOBOCAN2022年数据和淋巴瘤诊疗指南(2022年版),2022年中国新发非霍奇金淋巴瘤(NHL)80829例,DLBCL占比35%~50%。我们假设患者人群2.4万人,渗透率20%,单患者治疗费用12万元/年,用药时长2年,西达本胺新增DLBCL适应症销售峰值有望达11.7亿元。
(2)mCRC适应症销售峰值有望达22.1亿元
2024年5月12日,西达本胺联合信迪利单抗和贝伐珠单抗治疗≥2线标准治疗失败的晚期微卫星稳定或错配修复完整(MSS/pMMR)型结直肠癌(mCRC)的Ⅲ期临床试验获得国家药监局药审中心受理;2024年6月2日,国家药品监督管理局药品审评中心拟将西达本胺三联治疗mCRC方案纳入突破性治疗品种。
根据GLOBOCAN统计数据,2022年中国结直肠癌发病人数(51.71万人,男性30.77万人,女性20.94万人)和死亡人数(24.00万人)在全部恶性肿瘤中分别位居第二位和第四位。我们假设mCRC患者人群25万人,渗透率30%,人均治疗费用6万元,西达本胺mCRC适应症研发成功率50%,销售峰值有望达22.1亿元。
全球首个治疗T2DM的PPAR全激动剂有望拓展NASH适应症
(1)西格列他钠国谈进医保后加快准入
西格列他钠于2023年1月通过谈判成功纳入《2022年版国家医保药品目录》(2023年3月1日起执行)后,公司自营团队联合合作伙伴大力推动西格列他钠在公立医疗机构的准入工作。根据2023年年报数据,西格列他钠已准入医院1052家,覆盖全国1850家药店。
(2) NASH 临床 II 期获得积极结果
2024 年 2 月 22 日,由首都医科大学附属北京友谊医院牵头,在 24家临床中心开展的西格列他钠单药治疗 NASH的 II期临床试验(CGZ203)顺利完成了数据清理并锁库; 初步结果显示,在试验设定的首要疗效终点上,相比安慰剂对照,西格列他钠两个剂量组均具有统计学显著意义且剂量依赖的降低。
盈利预测与估值
我们预计公司 2024-2026 年营业收入分别为 6.80/8.91/11.49 亿元,同比增速 30%/31%/29%;归母净利润分别为-1.11/-0.55/0.45 亿元。根据 DCF 估值模型,按永续增长率 1.00%, WACC 6.05%, 测算得出合理市值为 112.56 亿元。首次覆盖,给予“买入”评级。
风险提示
创新药研发不及预期风险;新产品放量不及预期风险;医保支付政策调整带来的风险;地缘政治风险。
中心思想
原创新药驱动多适应症拓展
微芯生物作为原创新药领域的先行者,正通过其核心产品西达本胺和西格列他钠的多适应症拓展,积极抢占肿瘤和代谢疾病的广阔市场。西达本胺在弥漫大B细胞淋巴瘤(DLBCL)和晚期结直肠癌(mCRC)等适应症上取得显著临床突破并获批或进入关键临床阶段,预计将带来数十亿级的销售峰值。同时,西格列他钠作为全球首个PPAR全激动剂,在2型糖尿病(T2DM)市场实现高速增长,并在非酒精性脂肪性肝炎(NASH)领域展现出巨大潜力。
国际化与市场增长潜力显著
公司不仅深耕国内市场,更通过海外专利授权和全球研发积极推进国际化进程。其稳健的财务表现,特别是西格列他钠纳入医保后的强劲增长,以及丰富且进展积极的在研管线,共同构筑了公司未来的增长基础。尽管短期内面临研发投入和市场放量挑战,但微芯生物凭借其创新能力和战略布局,有望在未来几年实现盈利,并开启全球市场的新征程,具备显著的长期投资价值。
主要内容
核心产品市场潜力与临床突破
公司概况:原创新药领域开拓者,稳步推进全球化进程
微芯生物作为科创板首家生物医药企业,自2001年成立以来,专注于恶性肿瘤、代谢性疾病、自身免疫性疾病、中枢神经系统疾病及抗病毒五大领域的原创新药研发。公司已发展成为集早期研究、临床开发、产品生产及营销于一体的现代生物医药企业,拥有超过1000名员工,其中研发人员占比30%,博士占比10.5%。公司实施全球化知识产权战略,截至2023年底已申请发明专利660余项,获授权180余项,核心产品西达本胺和西格列他钠的专利保护期分别延长至2042年和2040年,确保了其长期市场竞争力。公司股权结构稳定,实控人鲁先平先生及其一致行动人合计持有27.54%股权,高管团队具备丰富的全球药物研发及管理经验,为公司发展提供有力支撑。
财务表现与未来增长展望
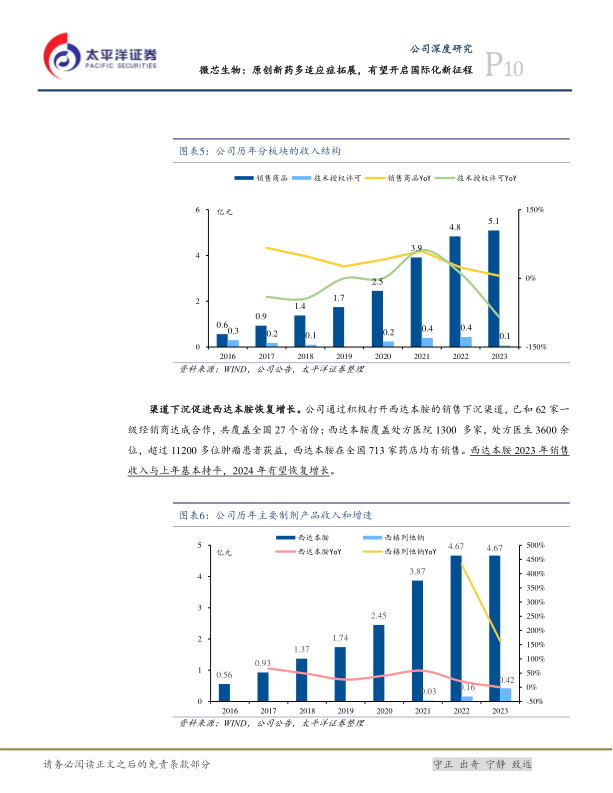
公司财务表现稳健,2016-2023年营业收入复合年均增长率(CAGR)约29.58%,归母净利润CAGR约37.70%。2023年营业收入为5.24亿元,同比下降1.18%,主要系西达本胺美国授权里程碑收益减少。然而,归母净利润达0.89亿元,同比大幅增长408.09%,主要得益于微芯新域不再纳入合并报表范围确认的投资收益。2024年第一季度,公司营业收入1.31亿元,同比增长22.60%,主要由西格列他钠销售高速增长驱动;归母净利润为-0.18亿元,亏损同比收窄。销售商品是公司主要收入来源,2023年占比97.16%。西达本胺通过渠道下沉,覆盖1300多家医院和11200多位肿瘤患者,2023年销售收入与上年基本持平,预计2024年将恢复增长。西格列他钠在2023年1月纳入国家医保后,销售收入同比增长162.5%,2024年Q1同比增长3126.77%,实现爆发式增长。公司毛利率长期维持在90%左右高位,期间费用率在2024年Q1有所下降,其中销售费用率和研发费用率下降明显,显示出良好的成本控制能力。
西达本胺:新增DLBCL和mCRC适应症有望达33.8亿峰值
西达本胺是公司首个获批上市产品,作为新机制表观遗传调控药物,通过抑制HDAC亚型引发染色质重塑,抑制肿瘤细胞周期、诱导凋亡,并调节细胞免疫。它是中国首个获批治疗复发或难治性外周T细胞淋巴瘤(PTCL)的原创化学新药,也是全球首个亚型选择性组蛋白去乙酰化酶(HDAC)口服抑制剂。PTCL关键性II期临床试验结果积极,中位总生存期(OS)为21.4个月,客观缓解率为28%,安全性优于国际同类药物。2019年11月,西达本胺获批联合芳香化酶抑制剂用于激素受体阳性、HER2阴性、绝经后晚期乳腺癌患者,成为全球首个以实体肿瘤为适应症获批的表观遗传调控机制类药物,III期临床试验显示中位PFS显著延长。
在弥漫大B细胞淋巴瘤(DLBCL)领域,西达本胺联合R-CHOP方案用于MYC和BCL2表达阳性的DLBCL患者,三期临床试验期中分析显示可显著提高完全缓解率(CRR)并显示出无事件生存期(EFS)获益趋势。2024年4月30日,该适应症获批上市。根据GLOBOCAN 2022年数据,假设患者人群2.4万人,渗透率20%,单患者治疗费用12万元/年,用药时长2年,预计DLBCL适应症销售峰值有望达11.7亿元。
在晚期结直肠癌(mCRC)领域,微卫星稳定/错配修复基因正常(MSS/pMMR)型mCRC患者存在迫切未满足临床需求。中山大学徐瑞华教授团队在Nature Medicine发表的CAPability-01 II期临床试验结果显示,西达本胺联合信迪利单抗和贝伐珠单抗的三药联用方案对MSS/pMMR型mCRC患者表现出亮眼疗效,18周无进展生存(PFS)率达64.0%,总缓解率44.0%,中位PFS为7.3个月,安全性良好。2024年4月27日,该方案获CSCO指南鼓励推荐。2024年5月12日,该三联治疗方案的Ⅲ期临床试验获国家药监局药审中心受理,并于6月2日被拟纳入突破性治疗品种。根据GLOBOCAN 2022年数据,假设mCRC患者人群25万人,渗透率30%,人均治疗费用6万元,研发成功率50%,预计mCRC适应症销售峰值有望达22.1亿元。
西达本胺的国际化进程也在稳步推进,2006年与美国沪亚生物签署国际专利授权许可和国际临床合作开发协议。目前已在中国获批PTCL、乳腺癌和DLBCL三个适应症,在日本获批成人T细胞白血病和PTCL两个适应症,在中国台湾获批乳腺癌适应症。正在开展全球多中心一线治疗黑色素瘤的III期临床试验,并推进多项联合免疫治疗的临床研究。
西格列他钠:全球首个获批治疗T2DM的PPAR全激动剂
中国糖尿病患者人数超过1.41亿人,预计到2045年将增至1.74亿人,市场需求巨大。西格列他钠(商品名:双洛平®/Bilessglu®)是公司自主研发的国家1类新药,2021年10月获批上市,是全球首个获批治疗2型糖尿病(T2DM)的PPAR全激动剂。其通过激活α、γ和δ三个PPAR受体亚型,靶向胰岛素抵抗,改善血糖、血脂代谢紊乱,并潜在降低心血管并发症。III期临床CMAP研究显示,西格列他钠可显著降低糖化血红蛋白(HbA1c)、空腹血糖和餐后2小时血糖水平,CMAS研究表明其疗效优于西格列汀。2023年1月,西格列他钠成功纳入国家医保目录,加速了在公立医疗机构的准入。截至2023年底,已准入医院1052家,覆盖1850家药店,并获得3项行业专家共识推荐,通过自营团队和经销商积极拓展市场,已与96家一级经销商合作,覆盖30个省份。
在非酒精性脂肪性肝炎(NASH,现称MASH)领域,NASH与T2DM等代谢紊乱密切相关,F2-F3期潜在治疗人群在中国预计2030年将达1489万人,药物治疗市场空间巨大。西格列他钠单药治疗NASH的II期临床试验(CGZ203)于2024年2月22日完成数据清理并锁库,初步结果显示,在肝脂肪含量降低等首要疗效终点上,两个剂量组均具有统计学显著意义且剂量依赖的降低,并在次要疗效终点(肝细胞损伤、炎症和纤维化等无创性指标)上显示出改善趋势,安全性良好,预示着其在NASH治疗领域的巨大潜力。
在研管线:全球积极布局新增适应症
公司在研管线丰富,核心产品新适应症临床进展积极。西格列他钠联合二甲双胍治疗2型糖尿病的上市申请已受理;西达本胺联合R-CHOP用于DLBCL的上市申请已受理并获优先审评(已获批)。多项临床试验已完成入组,包括西格列他钠NASH适应症II期临床试验、西奥罗尼单药治疗小细胞肺癌III期研究、西达本胺+PD-1一线治疗非小细胞肺癌II期临床试验。同时,CS23546(口服PD-L1抑制剂)治疗晚期肿瘤I期临床试验、CS32582(TYK2)胶囊用于治疗银屑病的临床试验申请、西奥罗尼治疗胰腺癌临床试验申请以及西达本胺三药联用方案治疗晚期MSS/pMMR型结直肠癌Ⅲ期临床试验均已获得受理或批准。
西奥罗尼作为全球创新机制的三通路靶向激酶抑制剂,针对Aurora B/VEGFR/PDGFR/c-Kit/CSF1R等多个靶点,通过抑制肿瘤血管生成、有丝分裂和调节肿瘤微环境发挥抗肿瘤作用。其单药治疗复发/难治性小细胞肺癌的关键性III期临床试验已于2023年9月完成入组,数据读出后有望在2024年内递交国内上市申请。此外,西奥罗尼治疗卵巢癌的III期临床试验已完成入组过半,美国小细胞肺癌Ib/II期临床试验进展顺利,显示出其在多个肿瘤领域的应用前景。
盈利预测及估值
根据盈利预测,公司2024-2026年营业收入预计分别为6.80/8.91/11.49亿元,同比增速分别为30%/31%/29%。归母净利润预计分别为-1.11/-0.55/0.45亿元,预计2026年有望实现盈利。这一预测基于西达本胺DLBCL适应症获批及mCRC适应症的成功研发(成功率50%),预计2024-2026年营收同比增速10%/29%/19%。西格列他钠纳入医保后,预计2024-2026年营收同比增速150%/100%/60%。西奥罗尼有望在2024年递交上市申请,预计2025年开始贡献收入。基于DCF估值模型,按永续增长率1.00%、WACC 6.05%测算,合理市值为112.56亿元。首次覆盖,给予“买入”评级。
风险提示
公司面临创新药研发不及预期风险、新产品放量不及预期风险、医保支付政策调整带来的风险以及地缘政治风险。
总结
微芯生物作为一家专注于原创新药研发的生物医药企业,凭借其在肿瘤和代谢疾病领域的深厚布局和持续创新,展现出强大的市场增长潜力。核心产品西
-

医药日报:罗氏减重疗法CT-388二期临床成功
-

医药日报:Sarepta基因疗法Elevidys三期临床成功
-

化工行业周报:原油价格持续上涨,PTA-涤纶长丝、PVC等产品景气回升
-

医药日报:英矽智能ISM8969获FDA批准临床
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送