-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

血液瘤产品商业化持续推进,自免管线进展可喜
血液瘤产品商业化持续推进,自免管线进展可喜
-
下载次数:
2027 次
-
发布机构:
长城国瑞证券有限公司
-
发布日期:
2024-07-04
-
页数:
50页
诺诚健华(688428)
主要观点:
聚焦恶性肿瘤和自免领域,开发同类最佳或同类首创药物。公司是一家以卓越的自主研发能力为核心驱动力的创新生物医药企业,目前已构建了从源头创新、临床开发、生产到商业化的全产业链平台,产品布局聚焦于血液瘤、自身免疫性疾病和实体瘤等存在巨大未满足医疗需求和广阔市场空间的领域,覆盖小分子药物、单克隆抗体及双特异性抗体。公司核心产品奥布替尼已在中国和新加坡获批上市,并纳入国家医保目录和临床诊疗指南;核心产品Tafasitamab治疗方案已在香港获批上市,国内上市申请已于近期获NMPA受理;13款产品处于临床阶段,在中国和全球各地区推进多项临床研究。
奥布替尼商业化持续推进,新适应症有望年内提交NDA。奥布替尼是一款潜在同类最佳的高选择性、共价不可逆的口服BTKi;基于它特殊分子结构,其相较于其他已上市BTKi具有更精准的BTK激酶选择性。奥布替尼已获批三项适应症,其中r/rCLL/SLL和r/rMCL于2020年附条件获批上市,r/rMZL适应症于2023年附条件获批上市、为国内首个且唯一获批的BTKi;1LCLL/SLL(中国)和r/rMCL(美国)预计今年三季度提交NDA;另有多项适应症处于临床三期阶段。除此之外,奥布替尼和ICP-248联用于1LSLL/SLL患者的IND在今年获CDE批准开展。
Tafasitamab联合来那度胺国内BLA获正式受理,明年有望贡献业绩增量。Tafasitamab联合来那度胺疗法已在美国、欧洲和中国香港获批上市,国内上市申请已获NMPA正式受理。在患者可及性方面,Tafasitamab联合来那度胺疗法已作为临床急需药品获批在海南博鳌乐城国际医疗旅游先行区及大湾区为符合条件的DLBCL患者使用,且被多个省市纳入境外特殊药品商保目录。此外,Tafasitamab联合来那度胺的疗法于2022年首次被纳入《中国临床肿瘤学会(CSCO)淋巴瘤诊疗指南》,并作为II级推荐。Tafasitamab竞品数量较少,且相比大部分竞品具有进度领先优势和治疗费用优势
奥布替尼具有治疗B细胞信号通路异常引起的自身免疫性疾病的潜力。奥布替尼用于治疗ITP在已完成II期临床试验中展现出优异的疗效和良好的安全性,所有患者中36.4%(33名患者中的12名)达到主要终点,50mg组患者40%达到主要终点(15名患者中的6名);在12名达到主要终点的患者中,83.3%(12名患者中的10名)的患者实现了持久缓解(14-24周期间6次就诊中至少有4次血小板计数≥50×109/L);22名对糖皮质激素或静脉注射免疫球蛋白敏感的患者中:50mg组,75.0%达到主要终点(8名患者中的6名);该适应症的III期注册临床试验目前正在中国顺利推进中。此外,奥布替尼针对SLE的IIa期临床试验于2022年3月取得积极结果,可能成为潜在治疗SLE的first-in-classBTKi,并已在中国启动IIb期临床试验,其口服给药相比常用的SLE注射剂药物具有明显的优势。
NTRK突变为多癌种致病因素,公司研发策略关注儿科人群。公司的产品Zurletrectinib(ICP-723)是第二代泛TRKi,可克服第一代TRKi生的耐药性,用于治疗未接受过TRKi治疗,以及对第一代TRKi产生耐药的携带NTRK融合基因的晚期或转移性实体瘤患者。
Zurletrectinib目前已在中国大陆地区启动针对NTRK基因融合阳性的晚期实体瘤的成人和青少年(12岁+)患者的II期注册性临床试验;针对儿童患者(2周岁到12周岁)新剂型的IND申请已于2023年7月获CDE批准。公司预计2024年末或2025年初在中国大陆递交NDA。截至目前已观察到80%-90%的ORR。
投资建议:
我们对现有已上市产品奥布替尼(三个获批适应症)和预估2026年以前能上市的产品或适应症(Tafasitamab、Zurletrectinib、奥布替尼国内1LCLL/SLL和美国r/rMCL)做NPV估值,假设无风险利率Rf为2.27%(十年期国债收益率),市场预期投资回报率Rm为8%,所得税率为15%,永续增长率为1%,计算得出WACC为6.54%,通过DCF模型测算出公司总股权价值为235亿元人民币。
我们预计公司2024-2026年的收入分别为9.76/13.98/18.46亿元,归母净利润分别为-5.54/-5.98/-4.33亿元。考虑公司奥布替尼多项血液瘤适应症获批上市、新适应症上市申请在即,销售放量可期;Tafasitamab上市申请已获受理有望明年开始贡献业绩,自免管线推进顺利,公司总股权价值大于当前市值,我们首次给予其“买入”评级。
风险提示:
商业化进度不及预期、研发不及预期,人才流失风险,毛利率下滑风险,医保政策风险。
中心思想
创新驱动与多元化管线布局:聚焦未满足医疗需求
诺诚健华作为一家以卓越自主研发能力为核心的创新生物医药企业,已构建从源头创新到商业化的全产业链平台。公司战略性地聚焦于恶性肿瘤(特别是血液瘤)和自身免疫性疾病等存在巨大未满足医疗需求的领域,并积极拓展实体瘤管线。其产品布局涵盖小分子药物、单克隆抗体及双特异性抗体,致力于开发具有突破性潜力的“同类最佳”(best-in-class)或“同类首创”(first-in-class)药物。核心产品奥布替尼已在中国和新加坡获批多项血液瘤适应症并纳入国家医保,展现出优异的临床疗效和安全性,且新适应症的上市申请正在积极推进。另一核心产品Tafasitamab在国内上市申请已获受理,并在特定区域实现临床急需用药,进一步丰富了公司的血液瘤治疗方案。
核心产品商业化提速与市场增长潜力
公司通过持续高水平的研发投入,不断推动创新药的临床开发和商业化进程。尽管目前尚未实现盈利,这符合创新药企的行业发展阶段,但其充足的货币资金储备为大规模研发提供了坚实保障。奥布替尼的销售额持续增长,且随着更多适应症的获批和纳入医保,其市场渗透率和销售放量可期。Tafasitamab的上市有望在未来贡献新的业绩增量。此外,公司在自身免疫性疾病和实体瘤领域的前沿管线,如治疗ITP和SLE的奥布替尼、治疗AD和Ps的TYK2抑制剂,以及治疗胆管癌和NTRK融合阳性肿瘤的Gunagratinib和Zurletrectinib,均展现出显著的临床潜力,有望为公司带来新的增长点。分析师基于NPV估值模型,认为公司总股权价值高于当前市值,首次给予“买入”评级,凸显了其长期投资价值。
主要内容
一、聚焦恶性肿瘤和自身免疫性疾病领域,开发同类最佳或同类首创药物
1. 专注于解决未满足医疗需求,由优秀团队带领的创新驱动发展公司
诺诚健华是一家以自主研发为核心驱动力的创新生物医药企业,已构建从源头创新、临床开发、生产到商业化的全产业链平台。公司产品布局聚焦于血液瘤、自身免疫性疾病和实体瘤等存在巨大未满足医疗需求和广阔市场空间的领域,覆盖小分子药物、单克隆抗体及双特异性抗体,旨在开发同类最佳或同类首创药物。自2015年成立以来,公司通过自主研发和战略合作不断扩充核心产品管线,并于2020年和2022年分别在港交所和上交所科创板上市。核心产品奥布替尼已在中国和新加坡获批上市,并纳入国家医保目录和临床诊疗指南;Tafasitamab治疗方案已在香港获批上市,国内上市申请已获NMPA受理;另有13款产品处于临床阶段。公司由崔霁松博士和施一公院士联合创立,管理团队和顾问团队拥有丰富的医药行业经验,为公司发展注入远见卓识。
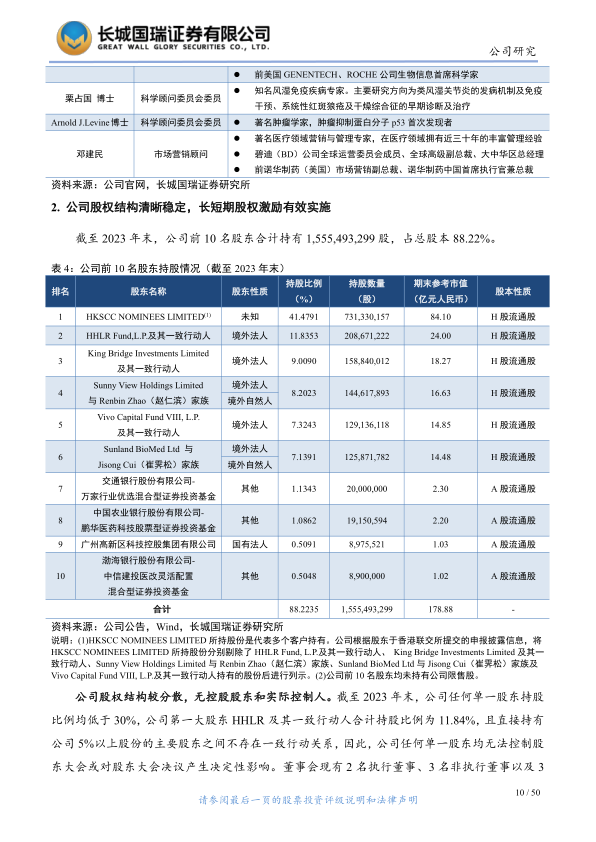
2. 公司股权结构清晰稳定,长短期股权激励有效实施
截至2023年末,公司前十大股东合计持有15.55亿股,占总股本的88.22%,股权结构分散,无控股股东和实际控制人。公司有效执行了多项员工股权激励计划,包括2015年、2016年、2018年首次公开发售前激励计划(股票期权、限制性股份单位)以及2023年股权激励计划和科创板限制性股票激励计划,通过设立专业信托管理,确保了激励的有效实施。截至2023年末,公司拥有4家境外子公司、6家境内子公司及1家合营企业,业务涵盖投资控股、临床开发、医疗及医药研究、生产以及营销推广服务,形成了多元化的业务布局。
3. 公司营收以药品销售业务为主,研发投入持续保持高水平
公司主营业务包括药品销售和研发服务,非主营业务包括技术授权和检测服务。2023年,药品销售收入占比高达90.93%(6.71亿元人民币),研发服务占比8.09%。奥布替尼于2020年12月获批上市后,药品销售收入迅速增长,从2021年的2.15亿元增长至2023年的6.71亿元,年复合增长率显著。2021年与Biogen的技术授权曾带来7.76亿元的显著收入,但该合作已于2023年终止。公司各项业务毛利率均保持较高水平,其中药品销售毛利率高达86.53%。尽管公司目前尚未实现盈利(2023年扣非归母净亏损6.26亿元人民币),这符合创新药企在研发投入期的行业特征。公司研发投入持续保持高水平,2022年和2023年分别为6.49亿元和7.57亿元人民币,均为费用化研发投入。截至2023年末,公司货币资金达82.97亿元人民币,充足的现金储备为持续大规模研发投入和发展运营提供了坚实保障。公司四项费用率均保持在合理水平,其中研发费用率持续高企,销售费用率通过提升运营效率有所降低。
二、同一枚硬币的正反面:恶性肿瘤与自身免疫性疾病
1. 持续增长的恶性肿瘤疾病负担
全球及中国癌症疾病负担持续增长,发病例数和死亡例数呈现上升趋势。根据Global Cancer Observatory的统计和预测,2020年全球癌症发病例数达1929.3万人,中国达456.9万人;死亡例数全球达995.8万人,中国达300.3万人。预计到2040年,全球发病例数将达3022.6万人,中国达684.6万人;死亡例数全球达1630.1万人,中国达507.1万人。全球、中国和美国十大高发癌症在结构上存在相似之处,乳腺癌、肺癌和结直肠癌均位居前列。中国癌症患者的5年生存率(40.5%)显著低于美国(66.9%),尤其在前列腺癌、睾丸癌、黑素瘤、淋巴癌和白血病等癌种中差距明显,表明中国在早期筛查诊断和新兴疗法应用方面仍有较大提升空间。全球肿瘤药物市场规模预计从2022年的2051亿美元增长至2030年的4586亿美元。中国肿瘤药物市场规模预计从2022年的2336亿元人民币增长至2030年的5866亿元人民币。血液肿瘤是严重影响人类健康的恶性疾病,淋巴瘤、急性髓细胞白血病(AML)、多发性骨髓瘤(MM)及急性淋巴细胞白血病(ALL)是中国四大血液肿瘤,于2022年占年度总发病数的79.4%以上。非霍奇金淋巴瘤(NHL)占淋巴瘤的90%,其中弥漫性大B细胞淋巴瘤(DLBCL)约占NHL发病率的41%。2020年全球NHL患病人数为256.9万人,预计2030年将达329.8万人;中国NHL患病人数为51.4万人,预计2030年将达73.0万人。
2. 自身免疫性疾病药物市场
自身免疫性疾病影响着大约1/10的人群,且19种常见自身免疫病的发病率和患病率呈整体上升趋势,女性患者更为常见。例如,一项发表在《柳叶刀》的研究显示,2017-2019年标化患病率为11.0%,高于2000-2002年的7.7%。现有疗法多为对症治疗,缺乏根治途径,且长期用药伴随已知潜在副作用,如传统抗炎疗法和JAK抑制剂(如托法替尼、乌帕替尼)可能增加严重心脏事件、癌症、血栓和死亡风险。因此,市场对更精准、安全、有效的靶向疗法需求迫切。BTK抑制剂因其在B细胞受体(BCR)信号通路中的关键作用,成为自身免疫性疾病的热门治疗靶点。全球自身免疫性疾病药物市场规模预计从2022年的1323亿美元增长至2030年的1767亿美元,年复合增长率稳定。中国市场增长潜力巨大,预计从2018年的20亿美元增长至2022年的29亿美元,并有望在2030年达到199亿美元,2022-2030年复合增长率高达26.7%,主要得益于庞大的人口基数、诊断技术进步和创新药物的迭代发展。
三、血液肿瘤领域全方位覆盖
1. 奥布替尼:潜在同类最佳的用于治疗血液瘤的口服BTKi
奥布替尼是一款潜在同类最佳的高选择性、共价不可逆的口服布鲁顿酪氨酸激酶(BTK)抑制剂。其特殊单环母核分子结构使其对BTK激酶具有更精准的选择性,脱靶效应更少。在对456种激酶的KINOME scan测定中,奥布替尼在1μM浓度下仅对BTK有>90%的抑制作用,而伊布替尼、阿可替尼和泽布替尼均表现出脱靶活性。这种高选择性理论上可减少腹泻、皮疹、出血和房颤等不良反应,从而提高患者的治疗耐受性和生活质量。临床数据显示,奥布替尼在任何疾病的腹泻(5.0%)、3级或以上房颤(0.0%)、继发性恶性肿瘤(0.5%)、重大出血
-

医药生物行业周报:医药生物行业双周报2026年第2期总第151期2026年JPM大会圆满落幕
-

医药生物行业双周报2026年第2期总第151期:2026年JPM大会圆满落幕 中国创新药资产成为全球焦点
-

医药生物行业周报:医药生物行业双周报2026年第1期总第150期脑机接口推荐性标准立项促进行业规范化《第四批鼓励仿制药品目录》发布
-

医药生物行业双周报2025年第24期总第147期:ASH数据催化临近,关注血液病与商保目录受益标的
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 医药产业研究周报:AI基建大时代,研发转场,医药格局将变
- 公司首次覆盖报告:小分子CDMO龙头,多肽与小核酸共筑新增长极
- 基础化工行业点评报告:水俣公约等多重因素加快氯碱落后产能退出,行业有望迎来历史性新变化
- 医药行业月报2026/01:25Q4医药持仓快速回落,占比创下新低
- 医药日报:罗氏减重疗法CT-388二期临床成功
- 基础化工行业研究:丙烯腈、煤焦油等涨幅居前,建议关注进口替代、纯内需、高股息等方向
- 基础化工行业周报:地缘冲突持续,美国天然气、碳酸锂涨幅居前
- 化工行业报告:中国将全面实施碳排放总量和强度双控制度,本周化工板块景气度抬升
- 仿制药基本盘稳健,小核酸打开成长天花板
- 化工行业2026年度策略:行业周期拐点已近,新材料蓄势腾飞
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送