-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

欧洲医疗保健制药业美国临床肿瘤学会(ASCO)摘要要点聚焦阿斯利康(AZN)和基因泰克(GMAB)
欧洲医疗保健制药业美国临床肿瘤学会(ASCO)摘要要点聚焦阿斯利康(AZN)和基因泰克(GMAB)
-
下载次数:
2777 次
-
发布机构:
高华证券
-
发布日期:
2025-05-23
-
页数:
9页
中心思想
ASCO摘要揭示欧洲生物制药市场新动向
本报告总结了高盛对2025年美国临床肿瘤学会(ASCO)会议摘要的分析,重点关注欧洲生物制药领域的关键进展。报告核心观点在于,阿斯利康(AZN)在非小细胞肺癌(NSCLC)领域的Dato-DXd联合疗法展现出积极信号,尤其在TROPION-Lung02试验中双药疗法的持久缓解数据令人鼓舞,尽管TROPION-Lung04试验中TIGIT机制的安全性仍需谨慎。同时,Genmab(GMAB)的Rina-S在子宫内膜癌治疗中显示出卓越的疗效,远超现有标准,具备高度市场竞争力。Immatics(IMTX)和Innate Pharma(IPH)的更新数据也提供了各自管线药物的最新进展,为投资者提供了重要的市场洞察和投资决策依据。
关键药物临床数据与投资策略分析
报告深入分析了各公司在ASCO会议上发布的临床试验摘要数据,包括疗效(如PFS、DOR、ORR)和安全性(如TEAE、停药率)的关键指标。高盛基于这些数据,对相关公司的投资评级和目标价进行了重申,并详细阐述了潜在的投资风险。例如,阿斯利康的Dato-DXd双药疗法在非鳞状NSCLC患者中的表现被视为对其AVANZAR试验的有力支持,而Genmab的Rina-S则因其在子宫内膜癌中显著的ORR和可控的安全性而备受关注。这些分析旨在为投资者提供专业、数据驱动的视角,以评估欧洲生物制药板块的未来走势和投资机会。
主要内容
阿斯利康(AstraZeneca)
阿斯利康在本次ASCO会议上公布了多项关键试验的摘要数据,其中TROPION-Lung02和TROPION-Lung04试验备受投资者关注,因其可能对AVANZAR试验产生交叉影响。
TROPION-Lung02试验:Dato-DXd联合疗法在非小细胞肺癌中的更新数据
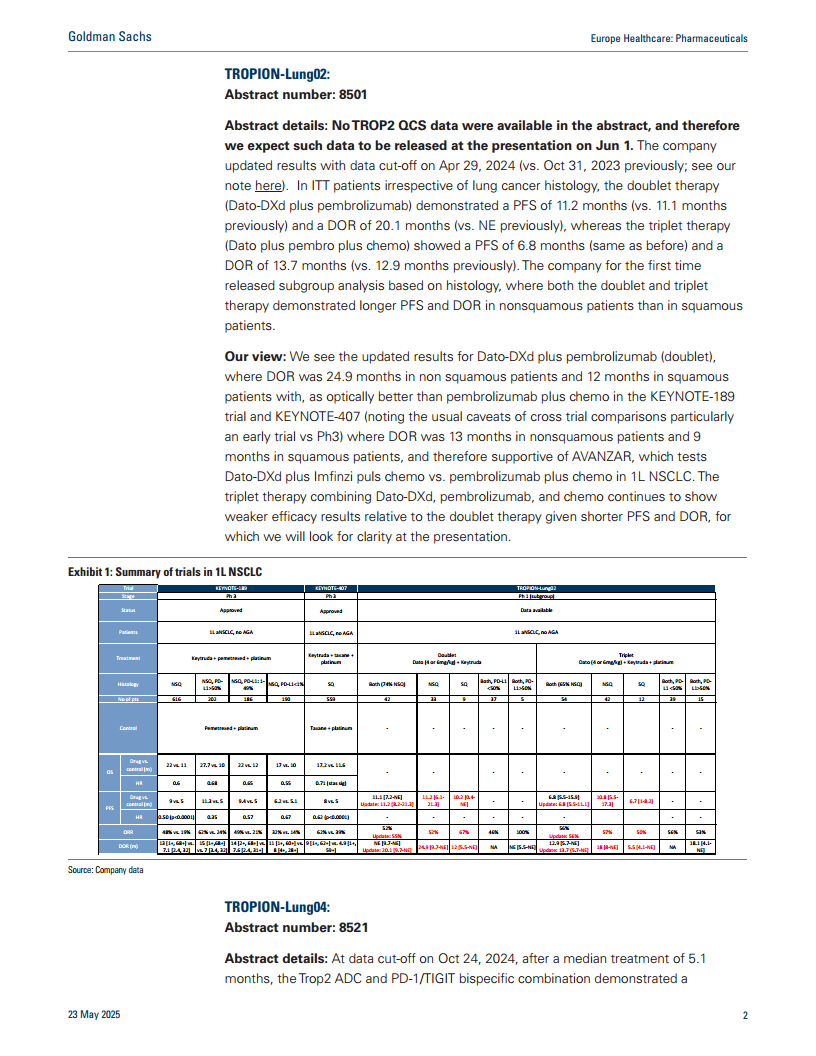
该试验(摘要号:8501)研究了Dato-DXd联合Pembrolizumab(+/-化疗)在一线NSCLC患者中的疗效。摘要中未提供TROP2 QCS数据,但更新了截至2024年4月29日的数据。
- 双药疗法(Dato-DXd + Pembrolizumab):在ITT患者中,中位无进展生存期(PFS)为11.2个月(此前为11.1个月),中位缓解持续时间(DOR)为20.1个月(此前为未达到)。
- 三药疗法(Dato-DXd + Pembrolizumab + 化疗):PFS为6.8个月(与此前相同),DOR为13.7个月(此前为12.9个月)。
- 组织学亚组分析:首次公布的亚组分析显示,双药和三药疗法在非鳞状细胞患者中均表现出比鳞状细胞患者更长的PFS和DOR。具体而言,双药疗法在非鳞状细胞患者中的DOR为24.9个月,在鳞状细胞患者中为12个月。
- 高盛观点:高盛认为,Dato-DXd联合Pembrolizumab双药疗法的更新结果,尤其是在非鳞状细胞患者中24.9个月的DOR,在视觉上优于KEYNOTE-189和KEYNOTE-407试验中Pembrolizumab联合化疗的DOR(非鳞状细胞患者为13个月,鳞状细胞患者为9个月),这为正在进行的AVANZAR试验提供了支持。AVANZAR试验旨在比较Dato-DXd联合Imfinzi加化疗与Pembrolizumab加化疗在一线NSCLC中的疗效。三药疗法相对于双药疗法继续显示出较弱的疗效,PFS和DOR均较短,高盛将关注后续报告以获取更多细节。
TROPION-Lung04试验:Dato-DXd与Rilvegostomig联合疗法在非小细胞肺癌中的初步结果
该试验(摘要号:8521)评估了Trop2 ADC和PD-1/TIGIT双特异性抗体联合疗法在一线晚期NSCLC患者中的表现。
- 疗效数据:截至2024年10月24日的数据显示,在中位治疗5.1个月后,该联合疗法确认客观缓解率(ORR)为57.5%,疾病控制率(DCR)为95%。在非鳞状细胞(ORR 62.1%)和鳞状细胞(ORR 45.5%)患者中均观察到缓解,且在不同PD-L1表达水平下均有效。DOR和PFS数据在分析时仍不成熟。
- 安全性数据:约23%的患者因不良事件(AE)停止Dato-DXd治疗,20%的患者停止Rilvegostomig治疗。常见的治疗相关不良事件包括口腔炎、疲劳、脱发、恶心、眼部事件和间质性肺病(ILD)。报告指出发生了6例治疗相关死亡,但摘要表明均非由研究药物引起。
- 高盛观点:高盛认为,该联合疗法58%的ORR与TROPION-Lung04中其他Dato-DXd/IO联合队列以及已获批的一线NSCLC IO/化疗联合疗法大致一致,支持进一步研究。然而,高盛对TIGIT机制仍持谨慎态度,尽管不良事件类型与Dato-DXd单药治疗观察到的情况一致,但作为一线疗法,停药率似乎偏高(中位治疗5个月后,Dato-DXd和Rilvegostomig的停药率分别为23%和20%,而KEYNOTE-189中为13.8%)。因此,高盛将密切关注公司管理不良事件的策略。
NeoCOAST-2试验:Imfinzi联合疗法在非小细胞肺癌新辅助/辅助治疗中的研究
该试验研究了Imfinzi联合Oleclumab(抗CD73)或Monalizumab(抗NKG2A)加化疗在NSCLC新辅助/辅助治疗中的应用。报告提及了该试验,但未提供具体的摘要数据或高盛的详细分析。
Genmab
Genmab将公布GTC1184-01试验中Rina-S在子宫内膜癌治疗的剂量扩展队列B3数据。
GTC1184-01试验:Rina-S在子宫内膜癌中的I/II期数据
该试验(摘要号:3039)的摘要数据截至2024年11月22日,涉及64名患者,这些患者此前平均接受过3线治疗,Rina-S剂量为100mg和120mg,中位治疗持续时间为15.9周。
- 疗效数据:Rina-S显示出50%的未确认客观缓解率(ORR),其中包括2例完全缓解(CR)。
- 高盛观点:高盛认为,Rina-S的疗效非常令人鼓舞,远超化疗(10-15%)以及TROP2 ADC(22-27%)的缓解率,这表明Rina-S在该领域具有高度竞争力的潜力。
- 安全性数据:安全性方面,持续缺乏眼部毒性是一个积极信号,相对于Elahere具有优势。3.1%的停药率表明总体耐受性可控。然而,高盛注意到120mg剂量组发生了一例5级治疗相关不良事件(TEAE),尽管摘要指出可能受合并症影响,但这将是后续报告的关注重点。
Immatics
Immatics将公布IMA203的I期临床更新数据。
IMA203试验:TCR-T疗法在PD1难治性转移性黑色素瘤中的I期更新
该试验(摘要号:2508)研究了靶向PRAME的自体TCR-T疗法IMA203在PD1难治性转移性黑色素瘤患者中的应用。
- 数据更新:摘要中的数据与公司2024年10月披露的2024年8月截止数据相同。
- 高盛关注点:高盛将关注口头报告中关于疗法持久性的更新。
Innate Pharma
Innate Pharma将公布Lacutamab在蕈样肉芽肿(MF)中的II期TELLOMAK试验数据。
TELLOMAK试验:Lacutamab在蕈样肉芽肿中的II期数据
该试验(摘要号:2523)的最新数据截止日期为2024年10月17日(此前为2024年3月),涉及107名中位接受过4线治疗的MF患者。
- 疗效数据:根据Olsen 2011标准,全球确认ORR为19.6%(此前为16.8%),皮肤缓解率为29.0%。中位缓解时间为2.8个月,中位缓解持续时间(DoR)为13.8个月,中位无进展生存期(PFS)为10.2个月。
- KIR3DL2表达亚组分析:
- 在KIR3DL2表达≥1%的患者中,ORR仍为20.8%,皮肤缓解率为29.0%,中位PFS增至11.8个月(此前为10.2个月)。
- 在KIR3DL2表达<1%的患者中,ORR为18.6%,皮肤缓解率为25.4%,中位DoR为15.7个月,中位PFS为9.5个月。
- 安全性数据:最常见的治疗相关不良事件(TEAE)包括疲劳(12.1%)、恶心(13.1%)、乏力(11.2%)和关节痛(11.2%)。5/107(4.7%)的患者出现≥3级TEAE,4/107(3.7%)报告了严重相关TEAE,3/107(2.8%)因Lacutamab治疗而停药。
估值与风险
高盛对所覆盖的欧洲生物制药公司进行了估值分析,并列出了关键风险。
阿斯利康 (AstraZeneca)
- 评级与目标价:买入评级,12个月目标价为14,482p(ADR $96)。
- 主要风险:临床试验失败、商业执行不力、定价压力、竞争加剧以及专利到期风险。
Genmab (Genmab)
- 评级与目标价:中性评级,12个月目标价为DKK1,785/$25.0。
- 主要风险:关键收入驱动因素(特别是Darzalex、Kesimpta和Epkinly)的商业表现好坏、DLBCL和多发性骨髓瘤领域的竞争发展以及关键管线资产的临床数据好坏。
Immatics (Immatics)
- 评级与目标价:买入评级,12个月目标价为$9.00。
- 主要风险:专有项目临床数据令人失望或负面、竞争对手项目临床数据更优以及临床开发速度慢于预期。
Innate Pharma (Innate Pharma)
- 评级与目标价:中性评级,12个月目标价为€2.49/$2.59。
- 主要风险:Lacutamab的商业表现好坏、Monalizumab在NSCLC中的市场机会大小以及关键管线(Monalizumab、Lacutamab和ANKET平台)的临床进展好坏。
总结
本次高盛报告对2025年ASCO会议摘要进行了专业且深入的分析,聚焦于欧洲生物制药公司的关键临床进展及其市场影响。报告指出,阿斯利康在非小细胞肺癌领域的Dato-DXd联合疗法,特别是TROPION-Lung02试验中双药疗法在非鳞状细胞患者中展现出的持久缓解数据,为未来的AVANZAR试验提供了积极信号,尽管TROPION-Lung04试验中TIGIT机制的安全性仍需密切关注。Genmab的Rina-S在子宫内膜癌治疗中表现出显著的疗效,其50%的未确认ORR远超现有标准,预示着强大的市场竞争力。此外,Immatics和Innate Pharma也公布了各自管线药物的最新数据,为市场提供了重要的更新。报告通过详细的统计数据和专业分析,不仅评估了各药物的疗效和安全性,还结合估值与风险分析,为投资者提供了全面的市场洞察,强调了临床试验结果、商业执行和竞争格局对公司未来表现的关键影响。
-

恒瑞医药(600276):恒瑞医药(600276.SS):ADA 2025:GLP-1产品组合的鼓舞性数据集;预计2026年首次推出
-

全球医疗保健:制药业:在即将推出的lenacapavir之前构建HIV暴露前预防(PrEP)市场框架
-

迈瑞医疗(300760):迈瑞(300760.SZ):投资者日要点:强调人工智能和经常性收入,拓展光谱分析 手术机器人领域;买入
-

中国医疗保健:来自我们全球医疗保健会议的解读以及美国市场的投资者反馈
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 2025年中国可穿戴医疗设备行业市场研究报告
- 2025年中国母婴医疗服务行业市场研究报告
- 医药日报:Enliven在研新药ELVN-001一期临床成功
- 基础化工行业周报:对日二氯二氢硅反倾销调查启动,中石化与中航油实施重组
- 基础化工行业周报:原油、丁二烯价格上涨,关注电子特气
- 化工行业报告:化工板块维持景气度,锰酸锂、电解液(磷酸铁锂)、碳酸锂、二乙二醇、NCM等产品涨幅居前
- 化工行业研究:丁二烯、丙烯腈等涨幅居前,建议关注进口替代、纯内需、高股息等方向
- 中国成人癌痛治疗药物行业调研简报|2025/10:国产新药迈入临床,癌痛治疗开辟新路径
- 医疗器械行业快评报告:八部门印发《“人工智能+制造”专项行动实施意见》,加快脑机接口产业化商业化进程
- 数字经济双周报(2026年第1期):前瞻布局未来产业:脑机接口量产与商业化提速
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送