-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

1.本月一致性评价仿制药申请信息
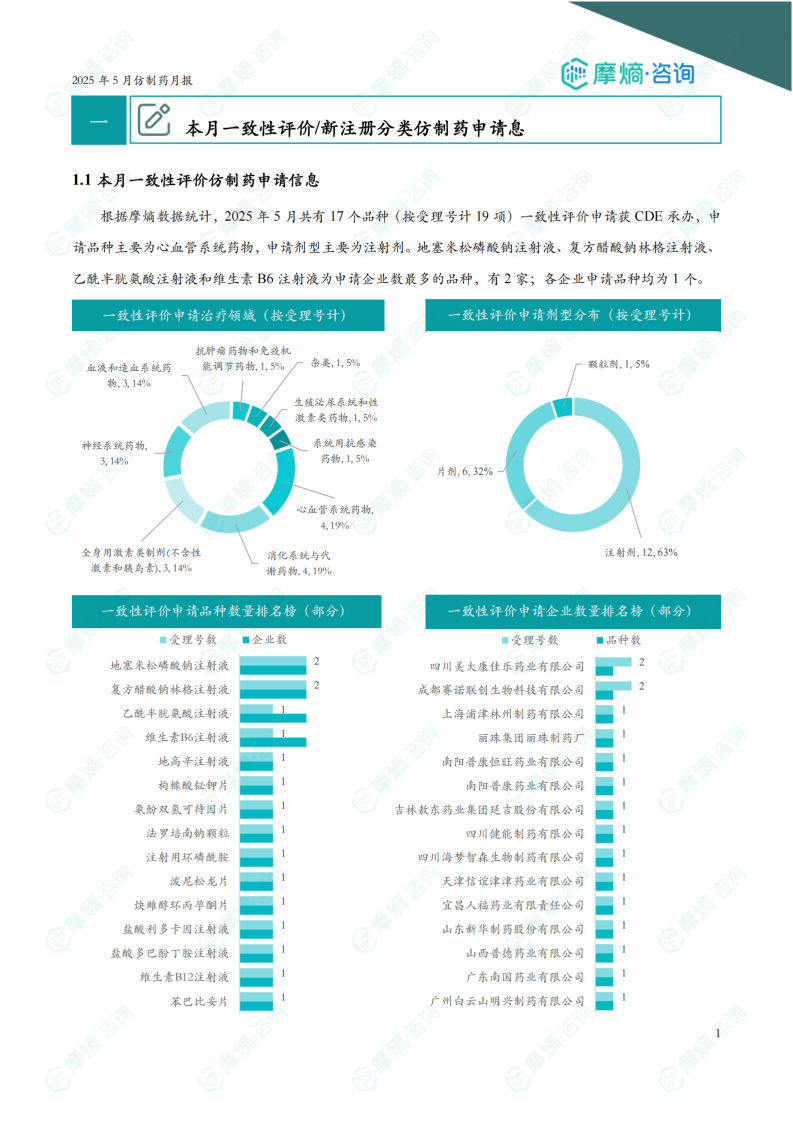
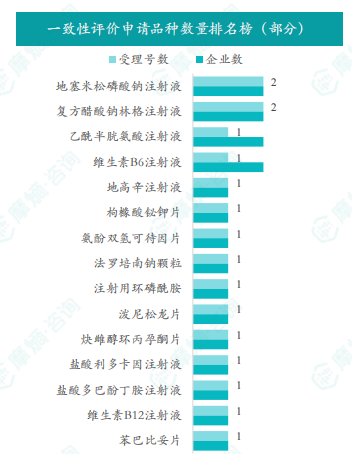
根据摩熵数据统计,2025年5月共有17个品种(按受理号计19项)一致性评价申请获CDE承办,申请品种主要为心血管系统药物,申请剂型主要为注射剂。地塞米松磷酸钠注射液、复方醋酸钠林格注射液、乙酰半胱氨酸注射液和维生素B6注射液为申请企业数最多的品种,有2家;各企业申请品种均为1个。
2.本月新注册分类仿制药申报临床/上市信息
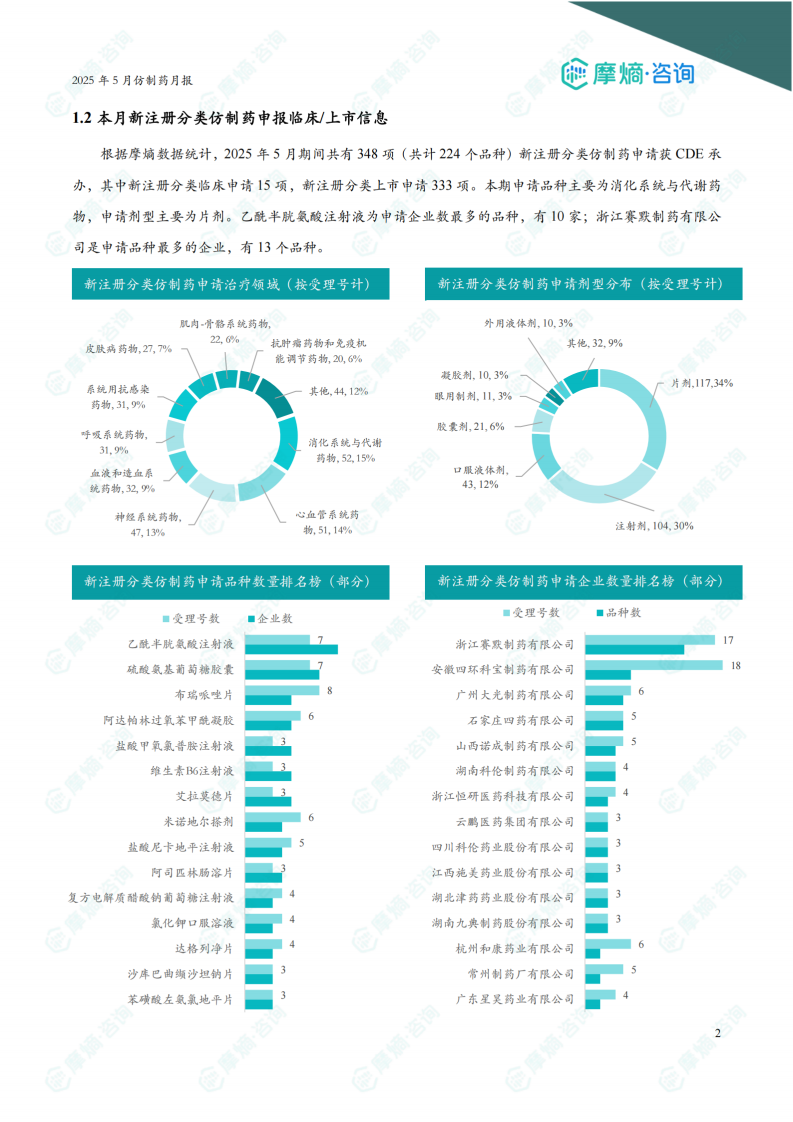
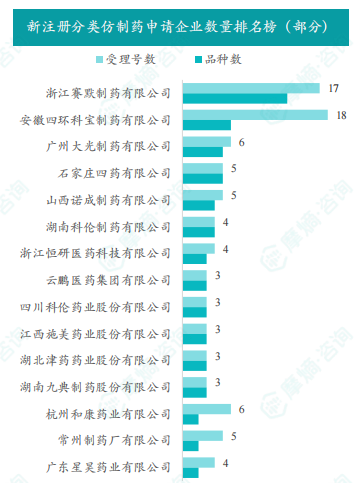
根据摩熵数据统计,2025年5月期间共有348项(共计224个品种)新注册分类仿制药申请获CDE承办,其中新注册分类临床申请15项,新注册分类上市申请333项。本期申请品种主要为消化系统与代谢药物,申请剂型主要为片剂。乙酰半胱氨酸注射液为申请企业数最多的品种,有10家;浙江赛默制药有限公司是申请品种最多的企业,有13个品种。
本报告涉及: 相关药物:他克莫司软膏, 相关适应症:银屑病 。
中心思想
本报告基于摩熵数据,对2025年5月中国仿制药市场进行了统计分析,核心观点如下:
一致性评价与新注册分类仿制药申请现状
5月份一致性评价和新注册分类仿制药申请数量均较大,体现了市场活跃度。一致性评价申请主要集中于心血管系统药物和注射剂剂型;新注册分类仿制药申请则主要集中于消化系统与代谢药物和片剂剂型。部分品种申请企业数量较多,显示出市场竞争激烈。
过评及获批上市情况及市场竞争分析
5月份共有162个品种通过或视同通过一致性评价,其中包括26个过评品种和142个视同通过品种。过评品种主要集中于心血管系统药物,部分品种已有4家企业过评,竞争激烈。此外,报告还分析了首家过评品种和达七家过评品种的市场情况,指出部分品种市场集中度高,头部企业占据主要市场份额。
主要内容
一、本月一致性评价/新注册分类仿制药申请信息
1.1 本月一致性评价仿制药申请信息
5月份共有17个品种(按受理号计19项)一致性评价申请获CDE承办。申请品种主要为心血管系统药物(占比19%),其次为消化系统与代谢药物(占比19%)和神经系统药物(占比14%)。申请剂型主要为注射剂(占比63%),其次为片剂(占比32%)。地塞米松磷酸钠注射液、复方醋酸钠林格注射液、乙酰半胱氨酸注射液和维生素B6注射液为申请企业数最多的品种,均有2家企业申请。 数据显示,注射剂剂型在一致性评价申请中占据主导地位。
1.2 本月新注册分类仿制药申报临床/上市信息
5月份共有348项(共计224个品种)新注册分类仿制药申请获CDE承办,其中临床申请15项,上市申请333项。申请品种主要为消化系统与代谢药物(占比15%),其次为心血管系统药物(占比14%)和神经系统药物(占比13%)。申请剂型主要为片剂(占比34%),其次为注射剂(占比30%)。乙酰半胱氨酸注射液为申请企业数最多的品种,有10家企业申请;浙江赛默制药有限公司是申请品种最多的企业,有13个品种。 数据表明,片剂剂型在新注册分类仿制药申请中占据较大比例。
二、本月过评/新注册分类仿制药获批上市信息
2.1 通过一致性评价信息
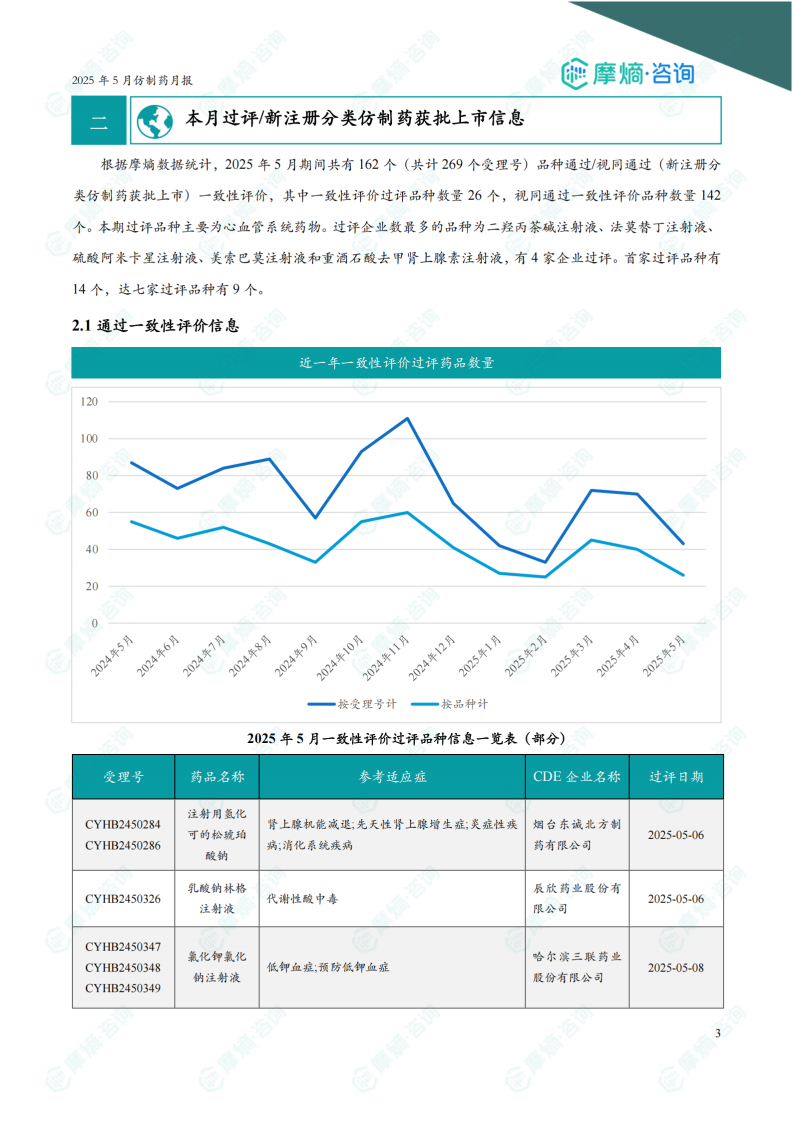
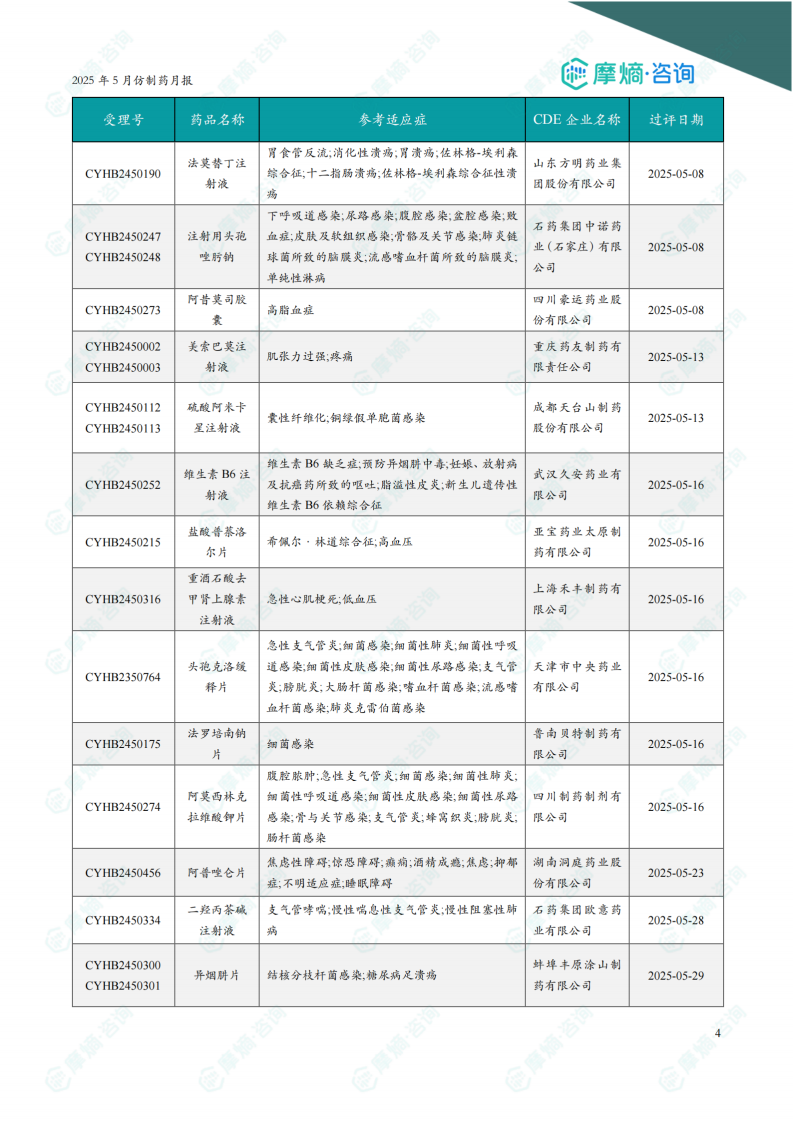
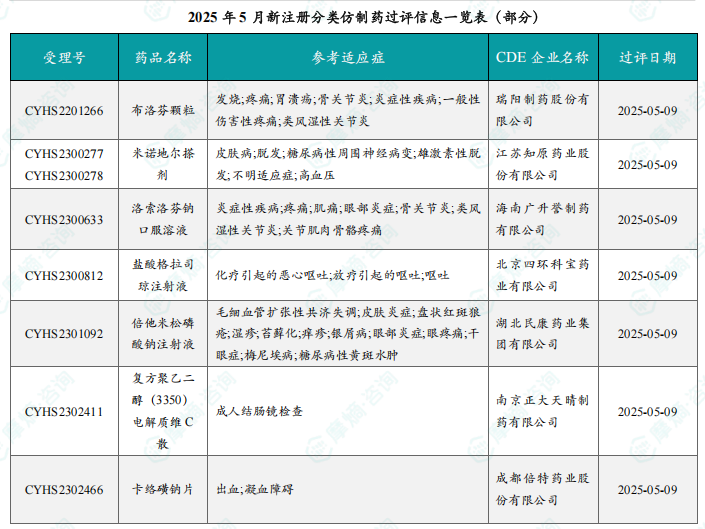
5月份共有26个品种通过一致性评价。过评品种主要为心血管系统药物。二羟丙茶碱注射液、法莫替丁注射液、硫酸阿米卡星注射液、美索巴莫注射液和重酒石酸去甲肾上腺素注射液为过评企业数最多的品种,均有4家企业过评。报告提供了部分过评品种的详细信息,包括受理号、药品名称、参考适应症、CDE企业名称和过评日期。图表显示近一年一致性评价过评药品数量趋势。
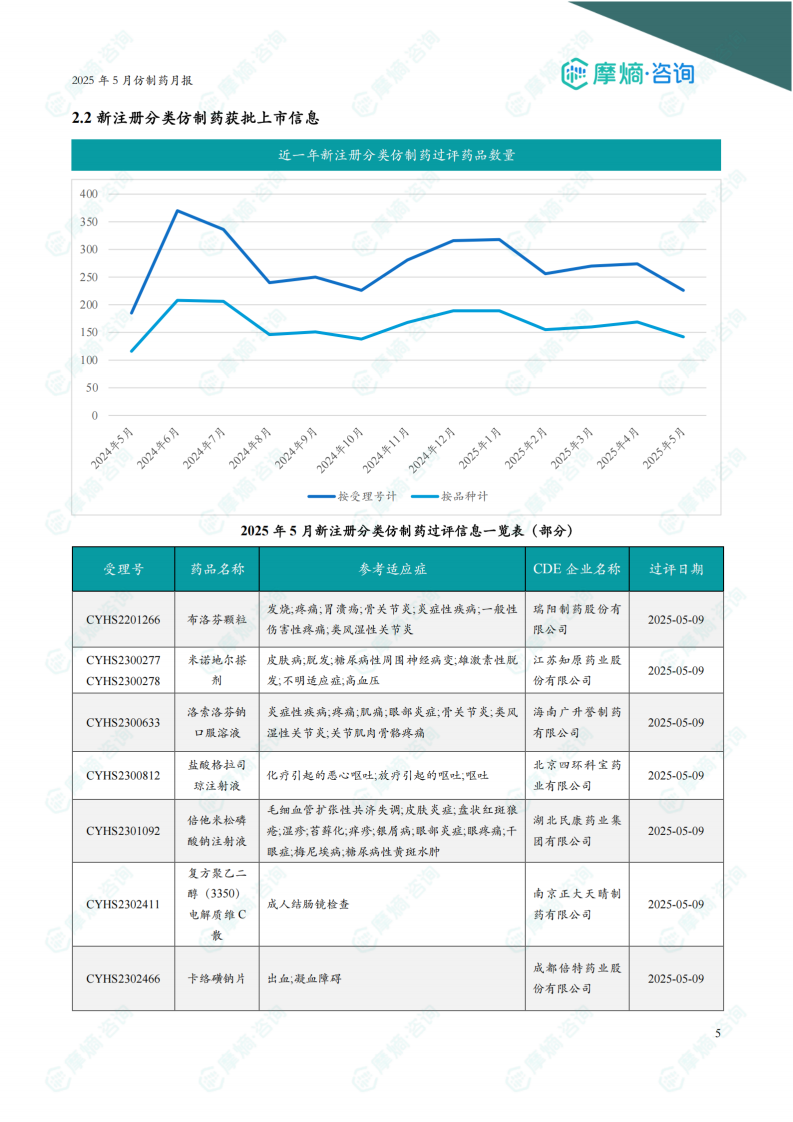
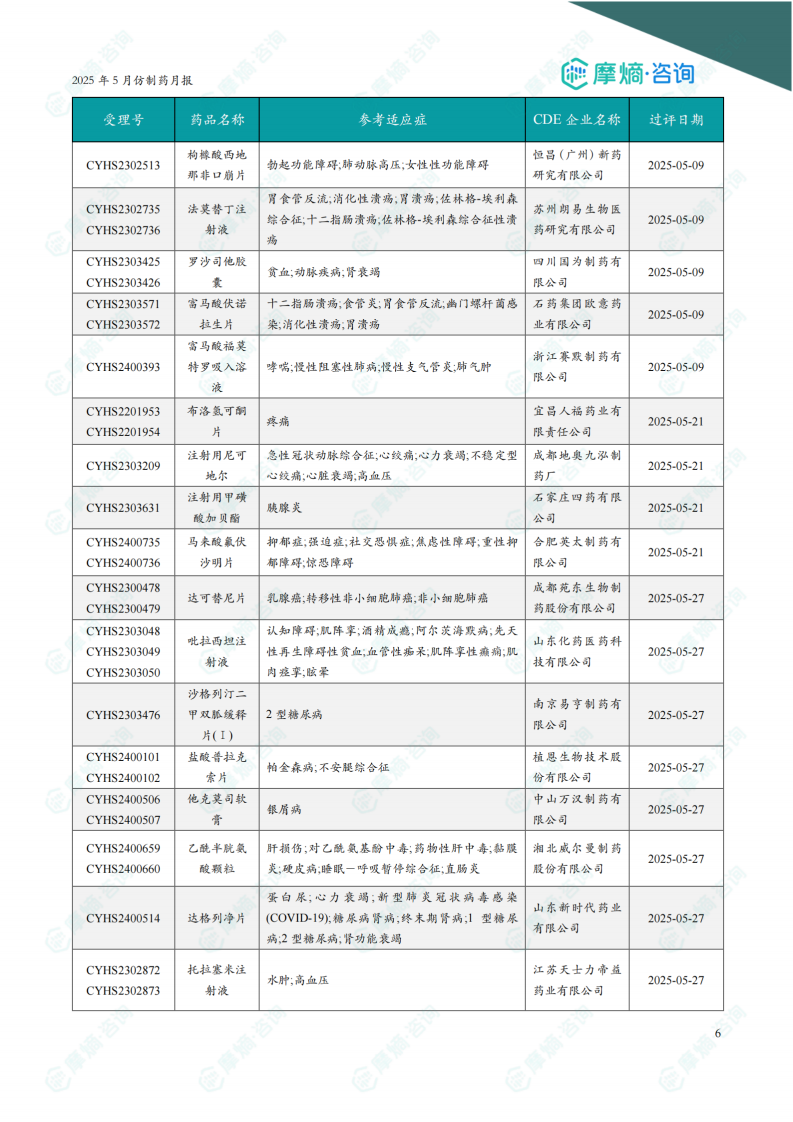
2.2 新注册分类仿制药获批上市信息
5月份共有142个品种视同通过一致性评价。报告提供了部分视同通过品种的详细信息,包括受理号、药品名称、参考适应症、CDE企业名称和过评日期。图表显示近一年新注册分类仿制药过评数量趋势。
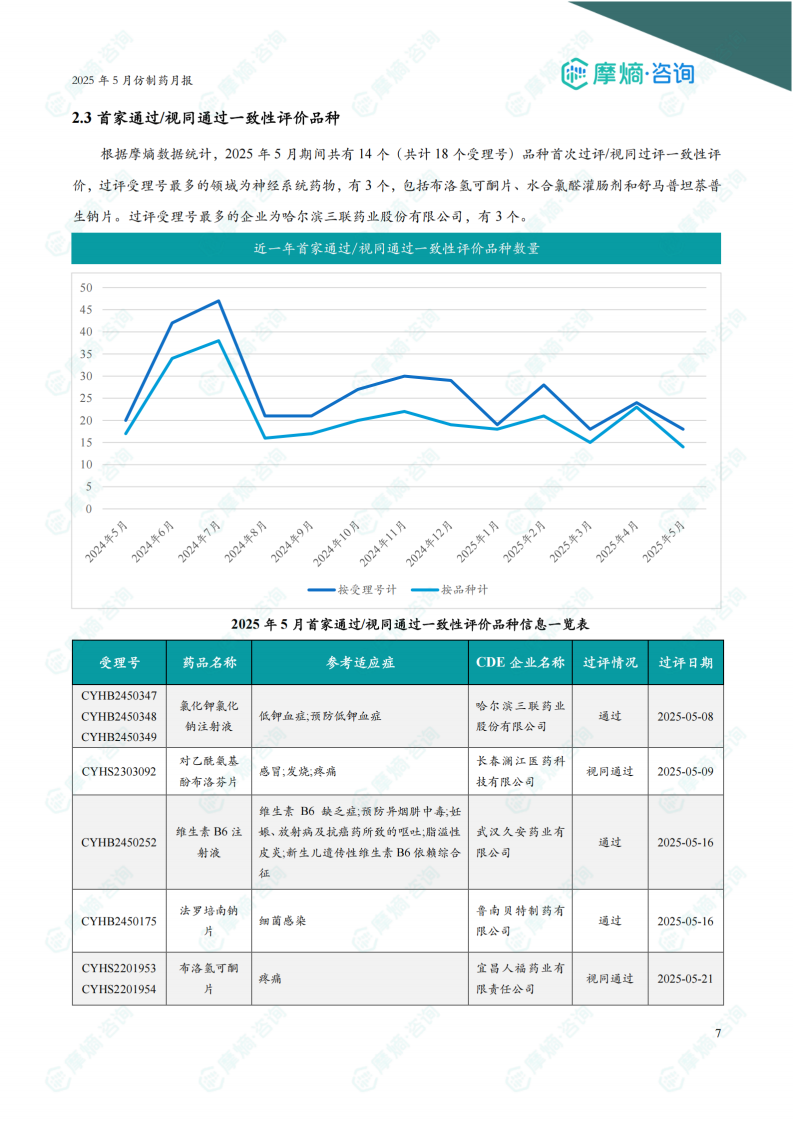
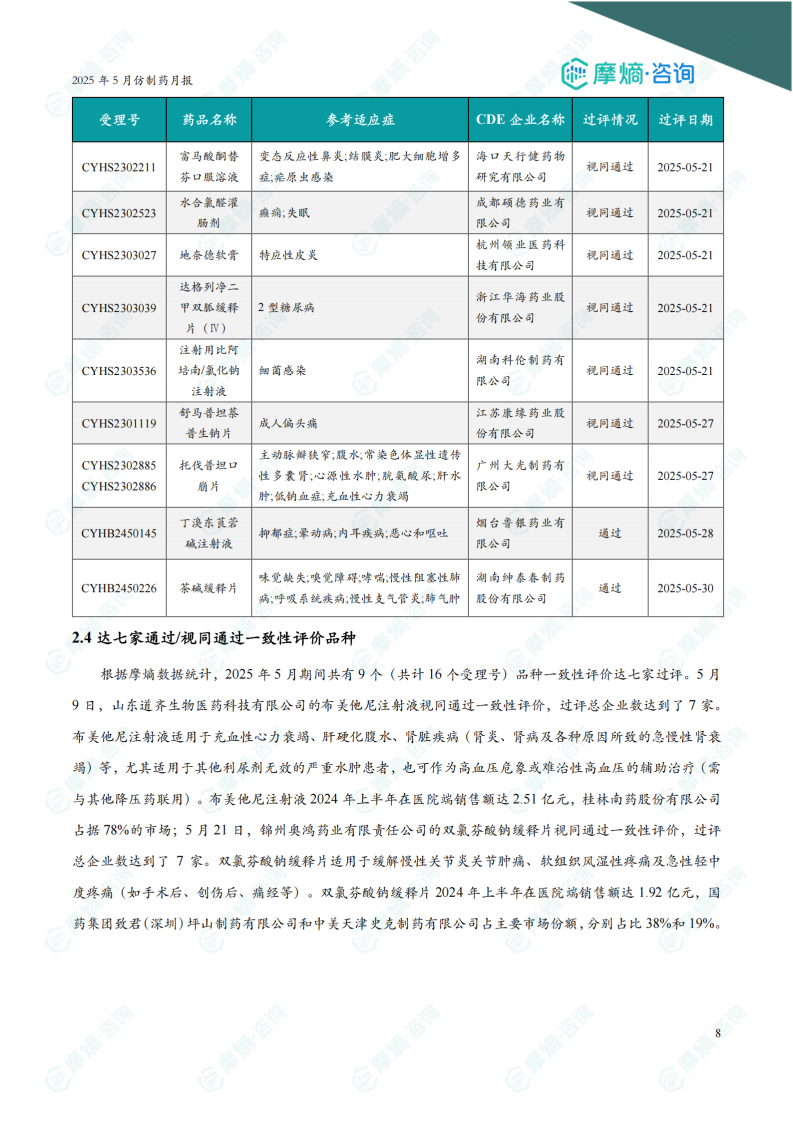
2.3 首家通过/视同通过一致性评价品种
5月份共有14个品种首次过评/视同过评一致性评价。过评受理号最多的领域为神经系统药物,有3个。哈尔滨三联药业股份有限公司过评受理号最多,有3个。报告提供了部分首家过评品种的详细信息,包括受理号、药品名称、参考适应症、CDE企业名称、过评情况和过评日期。图表显示近一年首家通过/视同通过一致性评价品种数量趋势。
2.4 达七家通过/视同通过一致性评价品种
5月份共有9个品种一致性评价达七家过评。报告详细分析了布美他尼注射液和双氯芬酸钠缓释片这两个达七家过评品种的市场情况,包括其适应症、市场销售额以及主要市场份额占据者。图表显示近一年通过/视同通过达七家品种数量趋势。
三、仿制药最新政策速递
报告列出了2025年5月份发布的与仿制药相关的政策文件,包括发布日期、标题、颁发部门和信息分类,共计十条政策信息,主要来自国家药品审评中心(CDE)和国家药品监督管理局。这些政策涵盖了原料药和制剂的稳定性试验、抗肿瘤药物生物等效性研究、化学仿制药参比制剂目录、老年医学科建设、儿童抗肿瘤药物研发等多个方面。
总结
2025年5月中国仿制药市场呈现出持续活跃的态势,一致性评价和新注册分类仿制药的申请数量均较高。市场竞争日益激烈,部分品种已有多家企业参与竞争。 注射剂和片剂仍然是主要的剂型。 监管部门持续发布相关政策,引导仿制药行业规范发展。 对市场参与者而言,需密切关注政策变化,加强研发创新,提升产品竞争力,才能在激烈的市场竞争中获得优势。 本报告的数据分析仅基于摩熵数据库,数据完整性和准确性以摩熵数据库为准。
-
 摩熵咨询医药行业观察周报(2025.05.26-2025.06.01)
摩熵咨询医药行业观察周报(2025.05.26-2025.06.01) -
 2025年5月全球在研新药月报
2025年5月全球在研新药月报 -
 摩熵咨询医药行业观察周报(2025.05.19-2025.05.25)
摩熵咨询医药行业观察周报(2025.05.19-2025.05.25) -
 2024年医药企业综合实力排行榜
2024年医药企业综合实力排行榜
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案





对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送