-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

CD38 单抗:MM 放异彩,开辟自免新蓝海
CD38 单抗:MM 放异彩,开辟自免新蓝海
-
下载次数:
1695 次
-
发布机构:
广发证券
-
发布日期:
2025-04-01
-
页数:
25页
中心思想
CD38单抗:血液瘤领域的成熟应用与自免领域的新增长点
本报告的核心观点在于,CD38作为一种多功能跨膜糖蛋白,已成为肿瘤和自身免疫疾病治疗领域的重要靶点。在血液学肿瘤领域,特别是多发性骨髓瘤(MM)的治疗中,CD38单抗已取得显著成功,以Daratumumab为代表的药物全球销售额突破百亿美金,并被纳入一线治疗指南优先推荐。这充分证明了CD38单抗在清除异常浆细胞方面的强大效力。更重要的是,基于其高效清除浆细胞的机制,CD38单抗正逐步开辟自身免疫疾病治疗的“第二成长曲线”,在肾移植排斥、膜性肾小球肾炎、IgA肾病、免疫性血小板减少症(ITP)以及系统性红斑狼疮(SLE)等多种自身免疫疾病中展现出巨大的治疗潜力,多款药物已进入II/III期临床阶段,预示着广阔的市场前景。
多功能靶点驱动的创新药投资机遇与潜在风险
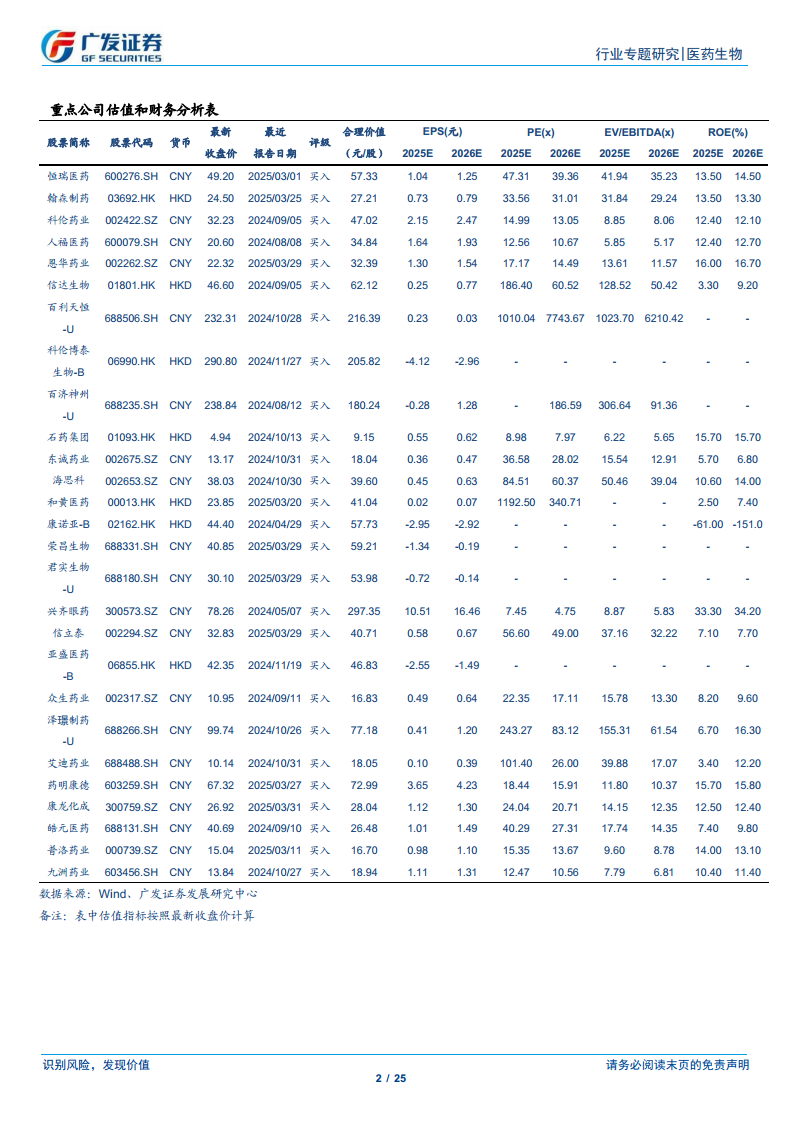
CD38靶点的多功能性及其在血液瘤和自身免疫病领域的广泛应用,为全球新药研发提供了新的方向和投资机遇。报告建议关注国内相关创新药企业和创新产业链企业,如恒瑞医药、翰森制药、信达生物、康诺亚等。然而,创新药研发周期长、投入大、风险高,面临研发失败、药品审评进度不及预期、医保降价超预期以及销售不及预期等潜在风险。因此,投资者在把握CD38单抗带来的市场机遇时,需充分评估并警惕相关风险。
主要内容
CD38靶点机制与全球竞争格局
CD38靶点概述与作用机制解析
CD38是一种II型跨膜糖蛋白,具有环化酶和水解酶的双重活性,参与核苷酸代谢,通过形成cADPR等第二信使调节细胞内Ca2+动员,进而影响淋巴细胞增殖、胰岛素分泌和T细胞活化等多种生物学过程。CD38在人体多种组织中表达,尤其在骨髓、淋巴结、胸腺、脾脏和扁桃体中含量较高,并在免疫细胞(如NK细胞、记忆B细胞、naïve B细胞、树突状细胞和浆细胞)中表达水平最高。研究表明,CD38的异常表达与多种恶性血液瘤的发生、发展及预后密切相关,使其成为重要的治疗靶点。
CD38单抗的作用机制多样,主要包括:1) Fc依赖性免疫效应机制,如抗体依赖的细胞毒作用(ADCC)、抗体依赖的细胞吞噬作用(ADCP)和补体依赖的细胞毒性(CDC),通过激活效应细胞或补体系统裂解肿瘤细胞;2) 诱导肿瘤细胞凋亡,部分单抗(如Daratumumab)需依赖FcγR交联,而另一些(如Isatuximab)可直接诱导凋亡;3) 调节免疫微环境,通过清除髓源性抑制细胞(MDSCs)、调节性T细胞(Tregs)和B细胞(Bregs)解除免疫抑制,并通过抑制CD38酶活性减少ADO生成,恢复T细胞、NK细胞及树突状细胞(DC)功能,增强免疫细胞活性。
全球竞争格局与主要CD38单抗体外活性比较
全球CD38单抗市场竞争激烈,Daratumumab(达雷妥尤单抗)作为首个上市的CD38单抗,由Genmab开发并授权强生,于2015年11月获FDA批准用于MM,并逐步扩展至一线治疗。2024年,Daratumumab全球销售额突破116.7亿美金,保持20%以上的增速。赛诺菲的Isatuximab是第二款上市的CD38单抗,在中美均获批治疗MM。此外,Felzartamab(MorphoSys/HI-Bio/Biogen/天境生物)已在国内递交MM上市申请,并获得美国FDA突破性疗法认定用于肾移植患者的晚期抗体介导排斥反应(AMR),目前已开展III期临床。武田的Mezagitamab和尚健生物的SG-301均已开展III期临床,康诺亚的CM313已开展5项II期临床。全球CD38单抗的适应症布局正从MM等血液瘤向移植物排斥、IgA肾病、ITP、SLE等自身免疫领域拓展。
在体外活性方面,不同CD38单抗展现出差异化特征:
- 抗原结合表位: CM313、Felzartamab与Daratumumab存在部分重叠,Isatuximab与Daratumumab无竞争,Mezagitamab与Daratumumab、Isatuximab均不重叠。
- 靶点结合亲和力: 各单抗亲和力均较高。
- CD38环化酶抑制活性: Isatuximab是唯一明确通过变构作用抑制CD38酶活性的单抗,其他CD38单抗为部分抑制。
- 免疫效应机制: Daratumumab具有广泛验证的强效CDC和ADCP活性,通过HexaBody®技术形成六聚体增强补体激活;Isatuximab的ADCC活性最强,但CDC活性与CD38高密度相关且易受补体抑制蛋白影响;CM313的ADCC效应略低于Dara,ADCP、CDC活性相当;Mezagitamab和Felzartamab能选择性耗竭浆细胞,ADCP可能为Felzartamab的主要机制。
- 诱导凋亡: Daratumumab和CM313依赖交联剂(CM313效率更高),Isatuximab通过活性氧(ROS)和溶酶体途径直接诱导凋亡,无需Fc交联剂。
血液学领域:多发性骨髓瘤与AL淀粉样变性
多发性骨髓瘤(MM)治疗进展
多发性骨髓瘤(MM)是一种血液系统恶性肿瘤,以骨髓中浆细胞聚集为特征,常导致骨质破坏和骨髓衰竭,在老年患者中更为常见。2023年美国估计有35,730例新发MM患者,12,590例患者死亡。中国发病率早于欧美,且晚期患者比例较高(DS分期Ⅲ期比例达85.5%)。
在NCCN多发性骨髓瘤指南中,达雷妥尤单抗已被纳入一线(无论是否适合移植)和二线优先推荐。对于适合移植的患者,首选DVrd方案(达雷妥尤单抗+硼替佐米+来那度胺+地塞米松),随后进行来那度胺维持治疗;对于不适合移植的MM患者,首选DRd方案。针对复发难治患者,指南也提供了基于CD38单抗的多种联合治疗方案。达雷妥尤单抗已获批多项MM适应症,覆盖单药、联合用药以及皮下剂型,并于2024年7月获批联合D-VRd用于新诊断且符合ASCT的MM的诱导/巩固治疗。
Daratumumab和Isatuximab均已获批治疗MM。ICARIA-MM研究(Isatuximab-Pd)和APOLLO研究(Daratumumab-Pd)分别探究了两种药物后线治疗MM的效果。尽管ICARIA-MM研究纳入患者基线更差,但两者的ORR和PFS数据差异不大。然而,APOLLO研究在深度缓解效果上表现更优,取得了更高的VGPR率、CR率和MRD阴性比例,且血液学毒性和中断比例更低。亚组数据显示,ICARIA-MM方案对有软组织浆细胞瘤和孤立性gain (1q21)的患者能显著改善中位PFS,对基线肾功能受损的患者在肾功能改善、维持稳定及提高肿瘤缓解率方面有优势。
免疫球蛋白轻链(AL)淀粉样变性及其他血液瘤应用
免疫球蛋白轻链(AL)淀粉样变性是一种罕见的系统性疾病,全球发病率为10例/100万人,由单克隆免疫球蛋白轻链错误折叠形成淀粉样蛋白沉积于组织器官。治疗目标是降低单克隆免疫球蛋白轻链水平,阻止淀粉样蛋白沉积,减轻或逆转器官功能障碍。达雷妥尤单抗联合硼替佐米、环磷酰胺和地塞米松(Dara-VCd)方案已获FDA加速批准用于治疗新确诊的AL淀粉样变性成年患者。基于III期ANDROMEDA研究,Dara-VCd方案与VCd方案相比,中位MOD-PFS未达到vs 30.2个月,5年生存率为76.1% vs 64.7%。Dara-VCd治疗组患者获得了更高的血液缓解率(42% vs 13%),且达到缓解的时间大大缩短,心脏缓解率(42% vs 22%)和肾脏缓解率(54% vs 27%)均增加一倍。亚洲患者亚组分析结果与总人群疗效获益趋势一致。
除了MM和AL淀粉样变性,CD38单抗在其他血液瘤中也显示出治疗潜力:
- 浆细胞白血病(PCL): 恶性程度高、预后差,PCL细胞常高表达CD38。单药达雷妥尤单抗治疗pPCL和sPCL患者的总体缓解率(ORR)分别为33%和25%。联合治疗可将ORR提高至60%以上。
- 前体T淋巴细胞白血病(T-ALL): 侵袭性血液系统恶性肿瘤,部分T-ALL细胞存在CD38表达。达雷妥尤单抗已开展治疗T-ALL的II期临床。
- 慢性淋巴白血病(CLL): CD38阳性比例相对较低,但高表达与患者预后不良相关。达雷妥尤单抗也已开展II期临床。
自免领域:肾脏疾病与免疫性血小板减少症的突破
肾移植排斥反应的治疗潜力
肾移植是终末期肾病(ESRD)患者最有效的治疗方法,但抗体介导的排斥反应(AMR)是导致移植物功能障碍的重要因素,主要由长寿命浆细胞产生的供体特异性抗体(DSA)引起。目前尚无获批用于治疗AMR的疗法,CD20抗体、蛋白酶抑制剂和补体抑制剂在临床中均未展现出明显疗效。
Felzartamab通过ADCC/ADCP介导的浆细胞与NK细胞耗竭,实现从抗体生成到效应杀伤的全链条干预,成为首个在晚期AMR中显示明确疗效的CD38靶向药物。2024年10月,Felzartamab获美国FDA突破性疗法认定用于治疗肾移植患者的晚期AMR,目前已开展III期临床。已披露的II期临床数据显示,Felzartamab组在24周时82%的患者AMR得到缓解,而安慰剂组仅为20%。Felzartamab组的微血管炎症评分、分子评分以及供体来源的无细胞DNA水平均低于安慰剂组。然而,52周时部分患者排斥反应复发,提示疗效持久性有待改善,可能需要持续治疗。安全性方面,首次输注时Felzartamab组73%的患者出现轻度或中度输注相关反应,感染是最常见的不良事件,但未观察到感染相关并发症的频率或严重程度大幅增加。
膜性肾小球肾炎与IgA肾病的临床进展
膜性肾病(MN)是一种自身免疫性肾脏疾病,主要由抗磷脂酶A2受体(PLA2R)抗体引起,导致免疫复合物在肾小球基底膜沉积。它是成人肾病综合征的常见病理类型,全球发病率为每100万人8-10例,我国发病率为23.4%。标准治疗方案(如皮质类固醇和环磷酰胺)约有10%的患者无法实现免疫缓解,利妥昔单抗联合周期疗法仍有20%-30%的耐药和复发风险。
Felzartamab在Ib/IIa期M-PLACE研究中,纳入31例抗PLA2R抗体阳性PMN患者。结果显示,在第一周时88%患者降低了抗PLA2R抗体,6个月时76.9%患者降低,其中30.8%实现免疫学完全缓解,23.1%实现免疫学部分缓解。多数患者血清白蛋白升高,24小时UPCR降低,eGFR在研究期间保持稳定。安全性方面,3-4级TEAE发生率25.8%,严重TEAE发生率16.1%,最常见不良反应为输注反应(61.5%)。基于II期数据,Biogen已启动大规模III期TRANSCEND试验。
IgA肾病(IgAN)是全世界范围内最常见的原发肾小球疾病,亚太地区为高发区,我国每年新增IgAN患者3万余人。IgAN发病机制涉及半乳糖缺乏的IgA1(Gd-IgA1)作为自身抗原诱发自身抗体产生,形成免疫复合物并沉积于肾小球系膜区,最终导致肾脏损伤。20%-40%的患者在10-20年内进展至终末期肾病(ESRD)。CD38单抗通过直接耗竭产生病理性自身抗体的浆细胞,抑制异常IgA和IgG自身抗体的产生,破坏病理性免疫复合物的形成,从而防止肾损伤,稳定肾功能。其对B细胞的选择性清除(而非全B细胞耗竭)理论上可减少感染风险。
Felzartamab的II期IGNAZ研究中期分析显示,Felzartamab治疗使UPCR出现快速且具有临床意义的降低,9剂方案效果最佳。在第6个月时,M3组UPCR较基线变化百分比为-35%,安慰剂组为+9%。第6个月观察到的蛋白尿减少持续至第15个月,M3组UPCR较基线变化百分比为-38%。各剂量组均出现IgA和Gd-IgA1水平下降,且在最后一剂给药10个月后仍持续降低。Felzartamab组eGFR相对稳定。WCN 2025更新的24个月完整随访数据显示,治疗后持续减少蛋白尿,并减轻肾功能的下降,IgA持续降低,IgG和IgM恢复,维持机体的免疫保护功能。安全性方面,不良反应多发生在首次输液时,感染性TEAE发生率与安慰剂组相近且均为1-2级。
Mezagitamab在POC研究中也表现出良好的耐受性。治疗期间,患者的血清IgA、IgG和gdIgA1水平随时间迅速且持续降低,尿蛋白肌酐比(UPCR)降低了55%,显示出最佳疗效。肾功能(eGFR)在36周内保持稳定,包括14周的停药期。
免疫性血小板减少症(ITP)的治疗前景
免疫性血小板减少症(ITP)是一种自身免疫疾病,表现为血小板受免疫性破坏和生成减少,患者面临更高的出血和瘀伤风险。2022年中国约有4.2万名新诊断ITP患者,随访患者达21.5万人。ITP治愈率较低,许多患者出现耐药性而容易复发,急需新的治疗方法。CD38单抗通过耗竭产生IgG的浆细胞,从源头上抑制IgG自身抗体的产生,导致针对血小板和巨核细胞的致病性自身抗体水平显著持续下降,有望成为ITP患者更好的治疗选择。
目前Mezagitamab和CM313均已披露后线治疗ITP的临床数据。两者均纳入重度经治患者(既往中位治疗线数约4线),并能实现快速且持续的缓解。
- CM313(I/II期): 在一周内快速起效,8周时95%患者达到≥2次连续计数≥50x10^9,血小板计数持续≥50x10^9/L的中位累积时间为23周,持久血小板响应率(定义为在最后8次血小板计数中观察到≥6次血小板计数≥50x10^9/L)为63.3%。21例患者在整个研究期间达到总体缓解,其中20例患者完全缓解。CM313还显著改善了患者的出血情况(基线出血比例68%,8周时5%)。安全性方面,大部分不良反应为输注反应(32%,均为2级),上呼吸道感染(32%,1-2级),仅1例患者发生3级不良反应(肛周感染)。
- Mezagitamab(IIb期): 在第16周时,600mg组实现90% PR,81.8% complete PR。出血比例从46.2%降至17.9%。≥G3 TEAE发生率17.9%vs23.1%,SAE发生率14.3%vs7.7%。
非头对头比较显示,CM313在安全性方面可能具有一定优势。
系统性红斑狼疮(SLE)的探索性治疗
系统性红斑狼疮(SLE)以多样的临床表现和难以预测的病程为特征,发病机制复杂,涉及自身免疫耐受破坏、T细胞功能异常和B细胞过度活化,导致自身抗体产生。中国的SLE患病率约30-70/10万人,患者总数约100万人,居全球第二。现有治疗方案主要实现部分缓解,完全缓解率较低,存在复发风险,且长期使用免疫抑制剂会导致感染、肝肾功能损害等不良反应。
分泌自身抗体的浆细胞是狼疮慢性炎症的重要驱动因素,而长寿浆细胞对标准免疫抑制剂治疗无反应。CD38因其在浆细胞上高度表达,可能为患者提供治疗选择。CD38单抗可以清除异常活化的B细胞和浆细胞,减少自身抗体的持续产生,同时还能恢复CD8+ T细胞的杀伤能力,改善免疫调节,并抑制浆细胞样树突状细胞分泌I型干扰素,减少免疫复合物的产生和沉积,从而缓解SLE的病理过程。2023年《Nature》杂志发布的一项研究数据显示,Daratumumab单药治疗6例难治性狼疮肾炎(LN)患者作为抢救疗法,3个月时5名患者均获得总体缓解(3名完全肾脏缓解,2名部分肾脏缓解)。在12个月观察期内,蛋白尿从平均5.6g/24h显著下降到0.8g/24h(p = 0.0010),且无严重不良事件发生。目前CM313、SG301、Felzartamab等均已开展SLE相关的I/II期临床。
总结
CD38单抗作为一种具有多重作用机制的创新疗法,已在血液学肿瘤领域取得了举世瞩目的成就,特别是Daratumumab在多发性骨髓瘤(MM)治疗中实现了百亿美金的销售额,并被广泛推荐。其高效清除浆细胞的能力,使其成为MM、免疫球蛋白轻链(AL)淀粉样变性及其他血液瘤治疗的重要基石。
更令人振奋的是,CD38单抗正凭借其独特的靶点优势,在自身免疫疾病领域开辟新的增长蓝海。在肾移植排斥反应、膜性肾小球肾炎、IgA肾病、免疫性血小板减少症(ITP)和系统性红斑狼疮(SLE)等多种自身免疫疾病中,多款CD38单抗已进入中后期临床试验阶段,并展现出积极的疗效数据,有望解决现有治疗方案的未满足需求。Felzartamab在晚期AMR中获得突破性疗法认定,以及在膜性肾小球肾炎和IgA肾病中显示的良好前景,Mezagitamab和CM313在ITP治疗中的快速持久缓解,以及Daratumumab在难治性狼疮肾炎中的探索性成功,都预示着CD38单抗在自免领域的巨大潜力。
尽管CD38单抗市场前景广阔,但创新药研发固有的高风险性不容忽视,包括研发失败、药品审评进度不及预期、医保降价超预期以及销售不及预期等风险。投资者在关注相关创新药企业和产业链企业时,需充分评估这些潜在风险,以做出审慎的投资决策。CD38单抗的持续发展,无疑将为全球医药市场带来新的活力和增长点。
-

港股行业研究系列:一键布局稀缺创新药标的
-

医疗保健行业:创新拓展空间,低估值有望迎修复
-

数据资产价值重估,AI技术驱动创新应用场景拓展
-

神经外科修复领域航母,多地集采执行或成为公司业绩释放关键
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 2025年中国可穿戴医疗设备行业市场研究报告
- 2025年中国母婴医疗服务行业市场研究报告
- 医药日报:Enliven在研新药ELVN-001一期临床成功
- 基础化工行业周报:对日二氯二氢硅反倾销调查启动,中石化与中航油实施重组
- 基础化工行业周报:原油、丁二烯价格上涨,关注电子特气
- 化工行业报告:化工板块维持景气度,锰酸锂、电解液(磷酸铁锂)、碳酸锂、二乙二醇、NCM等产品涨幅居前
- 化工行业研究:丁二烯、丙烯腈等涨幅居前,建议关注进口替代、纯内需、高股息等方向
- 中国成人癌痛治疗药物行业调研简报|2025/10:国产新药迈入临床,癌痛治疗开辟新路径
- 医疗器械行业快评报告:八部门印发《“人工智能+制造”专项行动实施意见》,加快脑机接口产业化商业化进程
- 数字经济双周报(2026年第1期):前瞻布局未来产业:脑机接口量产与商业化提速
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送