-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

泰它西普针对重症肌无力适应症获得 FDA“孤儿药”资格认定,加速抢占自免领域国际国内两个市场
泰它西普针对重症肌无力适应症获得 FDA“孤儿药”资格认定,加速抢占自免领域国际国内两个市场
-
下载次数:
2957 次
-
发布机构:
东亚前海证券有限责任公司
-
发布日期:
2022-10-13
-
页数:
5页
荣昌生物(688331)
事件
2022 年 10 月 12 日,荣昌生物宣布泰它西普获得美国 FDA 颁发的针对重症肌无力(MG)治疗的“孤儿药” 资格认定。
核心观点
泰它西普治疗重症肌无力(MG)获“孤儿药” 资格认定,加速其抢占国际市场。 重症肌无力(MG)是一种罕见的、慢性自身免疫性疾病,由针对突触后膜上乙酰胆碱受体、肌肉特异性激酶或其他乙酰胆碱受体相关蛋白的自身抗体引起,会导致神经肌肉接头传递受损,可不同程度影响眼球运动、吞咽、言语、活动和呼吸功能,约 85%的患者会出现眼肌以外的症状,发展为全身型重症肌无力(gMG),甚至发生肌无力危象,严重者甚至危及生命,已被纳入我国《第一批罕见病目录》。全球及中国重症肌无力治疗药物市场预计持续快速增长, 根据弗若斯特沙利文测算,全球 MG 治疗药物市场将从 2020 年的 12.6 亿美元增至 2025年的 30.48 亿美元, CAGR 达 19.3%,中国市场则是从 0.46 亿美元增至 2.5 亿美元, CAGR 达 40.2%。 目前, MG 的治疗仍以胆碱酯酶抑制剂、糖皮质激素、免疫抑制剂、静脉注射免疫球蛋白(IVIG)、血浆置换(PE)以及胸腺切除为主,生物药相对较少(仅有美国市场获批的亚力兄的 Soliris、依库珠单抗的长效版 Ultomiris 以及 Vyvgart 三款)。
此外, 部分患者因药物疗效、耐受性或使用禁忌等问题无法充分有效地控制病情,存在大量未被满足的临床需求。泰它西普治疗全身型重症肌无力(gMG)的国内 II 期临床研究此前已经完成,并获得积极阳性结果, 此次获得 FDA 授予的“孤儿药” 资质,泰它西普将享有税收减免、免申请费、研发资助、加快审批以及上市后 7 年市场独占权等权利,加速其释放在美国市场的价值。
广泛布局市场空间较大的多个自身免疫疾病,国内国际两个市场进展良好。 泰它西普目前布局的适应症有系统性红斑狼疮(SLE,中/美国)、类风湿关节炎(RA,中国)、 视神经脊髓炎谱系疾病(NMOSD,中国)、原发性干燥症(SS,中国)、 IgA 肾炎(中/美国)、多发性硬化症(MS,中国)、全身型重症肌无力(MG,中/美国),这些适应症大多市场空间较大但缺少有效治疗手段,泰它西普早期临床试验探索都取得了积极结果,有望满足未满足的临床需求。 从中国市场来看, RA 预计 2022 年底结束 III 期临床试验,有望 2023 年 Q1 申报 BLA; IgA 肾炎 II 期已做完,预计下半年进入临床 III 期; MG II 期临床试验已完成,有望下半年公布临床数据。 从美国市场来看, SLE 目前正在 III 期入组中,从此前已经公布的中国III期的数据来看,针对SLE泰它西普具有全球“Best-in-class”竞争力;针对 IgA 肾炎目前正在 II 期招募患者中;加上此次针对 MG 获得 FDA 的“孤儿药” 认定,可以说泰它西普在自身免疫疾病领域势如劈竹,价值正在逐渐绽放,成为“明日之星” 指日可待。
投资建议
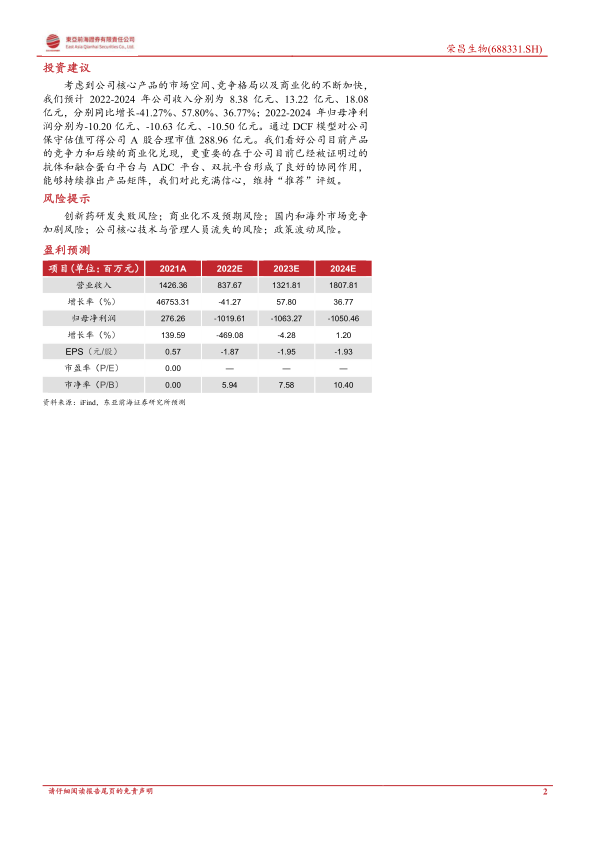
考虑到公司核心产品的市场空间、竞争格局以及商业化的不断加快,我们预计 2022-2024 年公司收入分别为 8.38 亿元、 13.22 亿元、 18.08亿元,分别同比增长-41.27%、 57.80%、 36.77%; 2022-2024 年归母净利润分别为-10.20 亿元、 -10.63 亿元、 -10.50 亿元。通过 DCF 模型对公司保守估值可得公司 A 股合理市值 288.96 亿元。我们看好公司目前产品的竞争力和后续的商业化兑现,更重要的在于公司目前已经被证明过的抗体和融合蛋白平台与 ADC 平台、双抗平台形成了良好的协同作用,能够持续推出产品矩阵,我们对此充满信心,维持“推荐”评级。
风险提示
创新药研发失败风险;商业化不及预期风险;国内和海外市场竞争加剧风险;公司核心技术与管理人员流失的风险;政策波动风险。
中心思想
- 泰它西普“孤儿药”资格认定意义:荣昌生物的泰它西普获得FDA授予的重症肌无力(MG)治疗“孤儿药”资格认定,加速了其抢占国际市场的进程,并有望享受税收减免、加快审批等优惠政策。
- 泰它西普市场前景广阔:泰它西普针对多个自身免疫疾病适应症的布局,以及国内外市场的良好进展,使其在市场空间巨大的自身免疫疾病领域具有广阔前景,有望成为“明日之星”。
主要内容
事件概述
- 2022年10月12日,荣昌生物宣布泰它西普获得美国FDA颁发的针对重症肌无力(MG)治疗的“孤儿药”资格认定。
核心观点
- 重症肌无力市场潜力巨大:全球及中国重症肌无力治疗药物市场预计持续快速增长,全球市场预计从2020年的12.6亿美元增至2025年的30.48亿美元,CAGR达19.3%,中国市场则从0.46亿美元增至2.5亿美元,CAGR达40.2%。
- 泰它西普竞争优势显著:泰它西普治疗全身型重症肌无力(gMG)的国内II期临床研究已完成并获得积极结果。获得FDA“孤儿药”资格后,将享有税收减免、免申请费、研发资助、加快审批以及上市后7年市场独占权等权利,加速其在美国市场的价值释放。
- 广泛的适应症布局:泰它西普目前布局的适应症包括系统性红斑狼疮(SLE)、类风湿关节炎(RA)、视神经脊髓炎谱系疾病(NMOSD)、原发性干燥症(SS)、IgA肾炎、多发性硬化症(MS)、全身型重症肌无力(MG)等,这些适应症市场空间大且缺少有效治疗手段。
- 国内外市场进展良好:中国市场,RA预计2022年底结束III期临床试验,有望2023年Q1申报BLA;IgA肾炎II期已做完,预计下半年进入临床III期;MG II期临床试验已完成,有望下半年公布临床数据。美国市场,SLE目前正在III期入组中,IgA肾炎目前正在II期招募患者中;加上此次针对MG获得FDA的“孤儿药”认定。
投资建议
- 盈利预测:预计2022-2024年公司收入分别为8.38亿元、13.22亿元、18.08亿元,分别同比增长-41.27%、57.80%、36.77%;2022-2024年归母净利润分别为-10.20亿元、-10.63亿元、-10.50亿元。
- 估值与评级:通过DCF模型对公司保守估值可得公司A股合理市值288.96亿元。维持“推荐”评级。
- 投资逻辑:看好公司目前产品的竞争力和后续的商业化兑现,以及公司已被证明过的抗体和融合蛋白平台与ADC平台、双抗平台形成的良好协同作用,能够持续推出产品矩阵。
风险提示
- 创新药研发失败风险
- 商业化不及预期风险
- 国内和海外市场竞争加剧风险
- 公司核心技术与管理人员流失的风险
- 政策波动风险
总结
- 核心产品市场潜力:荣昌生物的核心产品泰它西普获得FDA“孤儿药”资格认定,加速了其在重症肌无力治疗领域的国际市场拓展,并有望享受多项政策优惠。
- 维持“推荐”评级:考虑到泰它西普的市场空间、竞争格局以及商业化进程,维持对荣昌生物的“推荐”评级,并强调公司在自身免疫疾病领域的广阔前景和持续创新能力。
-

医药生物行业上市公司2022年年报及2023年一季报总结
-

化工行业22年及23年一季度业绩综述:行业整体估值处于低位,轮胎及烧碱行业业绩可期
-

光伏胶膜2022年年报及2023Q1业绩综述:需求保持高增,盈利有望修复
-

2022年年报&2023年一季报点评:投入期业绩有所扰动,关注长期经营效率提升
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
- 基础化工:2026年“两会”召开,重点关注“反内卷”、新质生产力、碳排放双控等议题
- 医药行业研究:靶蛋白降解:下一代颠覆性治疗范式迎来商业化元年
- 中国兽药产业全景透视:政策演进研发流程与市场格局
- 化工行业2月月报:中东局势升级
- 基础化工:天然气、甲醇等原料价格大涨,赢创调涨蛋氨酸价格
- 基础化工行业周报:地缘冲突扰动全球能化供应链,看好中国化工稳定供应全球
- 蛋氨酸行业快评:能源价格大幅推高成本,中国蛋氨酸竞争力凸显
- 医药行业周报:预期修正,关注长期价值
- 医药生物行业深度报告:投融资与出海双轮驱动,CXO迎来景气度修复与全球化新周期
- 新兴生物技术专题报告:小核酸药物方兴未艾,海外创新与国内崛起共振
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送