-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

抗新冠药物获临床批准,同机制新药国内进度第一
抗新冠药物获临床批准,同机制新药国内进度第一
-
下载次数:
1199 次
-
发布机构:
西南证券股份有限公司
-
发布日期:
2021-12-15
-
页数:
4页
前沿生物(688221)
事件: 公司收到国家药监局核准签发的《药物临床试验批准通知书》,抗新冠病 毒药物注射用 FB2001 的药物临床 I 期桥接试验申请获得批准。
同机制药物已显示优异的治疗效果。 FB2001 为 SARS-CoV-2 蛋白酶抑制剂,在实验动物体内展现出良好的体内药代动力学性质和安全性,国际权威期刊《 Science》 公布了部分前期研究数据: FB2001对新冠病毒 SARS-CoV-2 M的抑制活性 IC为 0.053±0.005μM,体外抗病毒活性 EC为 0.42±0.08μM,具有高效靶向冠状病毒主蛋白酶的活性。 辉瑞的抗新冠新药 Paxlovid 同为SARS-CoV-2 蛋白酶抑制剂,其中期数据分析显示: 与安慰剂相比,在症状出现后三天内接受治疗的患者(主要终点)因任何原因导致的新冠病毒-19相关住院或死亡的风险降低了 89%; 0.8%接受 PAXLOVID 治疗的患者在随机分组后的第 28 天内住院( 3/389,无死亡),而接受安慰剂治疗的患者中有 7.0%住院或死亡( 27/385, 7 例随后死亡), p<0.0001,疗效优异。
FB2001在国内同机制药物中进度最快, 全球及国内在研同类品种少,竞争格局良好。 全球有 3个 SARS-CoV-2抑制剂上市, 3个处于 III 期或 II/III 期临床, 2个 II 期临床, 1个 I 期临床。但 3 个已经上市和 1 个处于 III 期临床的药物是老药新用,目前来看治疗新冠的效果尚不能确定。全球进度最快的就是辉瑞的处于 III 期临床的 PAXLOVID,正在美国申请 EUA。 公司的 FB2001是国内同机制在研新药中进度最快的, 除此之外, 尚有 3 家公司处于临床前研究阶段。
疫情波动常态化, 抗新冠药物成为刚需品种, 国内仍有市场空间。 中国 2021年1 月 1日-2021年 12月 12日,共新增确诊的新冠患者 1.3万人,这一部分人是新冠药物的直接使用者。且国家可能对于新冠药物还有战略储备。因此国内新冠药物仍有市场空间。
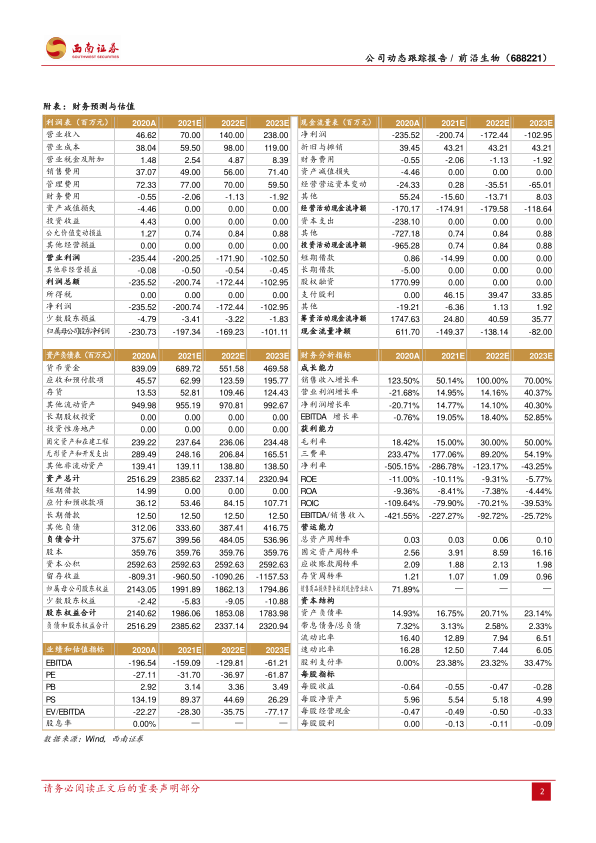
盈利预测。 我们预计 2021-2023年收入分别为 7000万元、 1.4亿元、 2.4亿元,归母净利润分别为-2.0亿元、 -1.7亿元和-1.0亿元, EPS 分别为-0.55元、 -0.47元、 -0.28 元。
风险提示: 艾可宁市场推广不及预期;研发进展不及预期
中心思想
前沿生物抗新冠药物FB2001临床获批,市场前景广阔
本报告核心观点指出,前沿生物自主研发的抗新冠病毒药物注射用FB2001获得国家药监局临床试验批准,标志着公司在抗击新冠疫情领域取得关键进展。该药物作为SARS-CoV-2蛋白酶抑制剂,与国际领先药物辉瑞Paxlovid机制相同,且已在体外和动物实验中展现出优异的抑制活性和安全性。鉴于其在国内同机制新药中处于领先地位,以及全球同类在研品种较少,FB2001有望在疫情常态化背景下,满足国内巨大的抗新冠药物市场需求,为公司带来新的增长机遇。
领先的研发进度与良好的竞争格局
FB2001的临床获批不仅彰显了前沿生物的研发实力,更使其在国内同机制抗新冠药物研发竞赛中占据先发优势。全球范围内,同类已上市或处于后期临床阶段的药物数量有限,且部分为老药新用,疗效尚待明确。FB2001的快速推进,结合其与已验证高效药物的相同作用机制,预示着其未来市场竞争力的强大。尽管公司短期内仍面临盈利压力,但抗新冠药物的刚性需求和潜在的国家战略储备,为FB2001的商业化前景奠定了坚实基础。
主要内容
抗新冠药物FB2001获临床批准
前沿生物(688221)于近期收到国家药监局核准签发的《药物临床试验批准通知书》,其自主研发的抗新冠病毒药物注射用FB2001的药物临床I期桥接试验申请获得批准。这一事件标志着FB2001正式进入临床研究阶段,是公司在抗击新冠疫情领域取得的重要里程碑。
同机制药物的优异治疗效果与FB2001的潜力
FB2001的作用机制与体外活性数据
FB2001是一种针对SARS-CoV-2病毒主蛋白酶(Mᵖʳᵒ)的抑制剂。在实验动物体内,该药物展现出良好的体内药代动力学性质和安全性。国际权威期刊《Science》公布的前期研究数据显示,FB2001对新冠病毒SARS-CoV-2 Mᵖʳᵒ的抑制活性IC₅₀为0.053±0.005μM,体外抗病毒活性EC₅₀为0.42±0.08μM,这些数据表明FB2001具有高效靶向冠状病毒主蛋白酶的活性。
辉瑞Paxlovid的临床疗效验证
与FB2001同为SARS-CoV-2蛋白酶抑制剂的辉瑞抗新冠新药Paxlovid,其中期数据分析显示了优异的治疗效果。与安慰剂组相比,在症状出现后三天内接受Paxlovid治疗的患者,因任何原因导致的新冠病毒-19相关住院或死亡的风险降低了89%。具体数据显示,在随机分组后的第28天内,仅有0.8%接受Paxlovid治疗的患者住院(3/389,无死亡),而接受安慰剂治疗的患者中有7.0%住院或死亡(27/385,7例随后死亡),p值小于0.0001,充分证明了该类机制药物的显著疗效。Paxlovid的成功为FB2001的未来临床表现提供了积极的参考和预期。
FB2001在国内同机制药物中的领先地位与竞争格局
全球同类药物研发概况
全球范围内,SARS-CoV-2抑制剂的研发和上市情况显示,目前有3个同类药物已上市,但这些药物多为老药新用,其治疗新冠的效果尚不能确定。此外,有3个药物处于III期或II/III期临床试验阶段,2个处于II期临床,1个处于I期临床。全球进度最快的同机制药物是辉瑞的PAXLOVID,目前正处于III期临床阶段,并已在美国申请紧急使用授权(EUA)。
FB2001的国内领先优势
在国内同机制在研新药中,前沿生物的FB2001是进度最快的。除了FB2001之外,目前国内尚有3家公司处于临床前研究阶段。这意味着FB2001在国内市场具有显著的先发优势,竞争格局良好。在同类新药研发中,率先进入临床并取得进展,将为公司赢得宝贵的市场窗口期。
疫情常态化下的抗新冠药物市场需求与空间
抗新冠药物的刚性需求
随着新冠疫情的常态化波动,抗新冠药物已成为全球范围内的刚需品种。在中国,2021年1月1日至2021年12月12日期间,共新增确诊新冠患者1.3万人。这部分患者是新冠药物的直接使用者,构成了明确的市场需求。
潜在的国家战略储备需求
除了直接患者需求外,国家层面可能还会对抗新冠药物进行战略储备,以应对未来可能出现的疫情反复或大规模爆发。这种战略储备需求将进一步扩大国内抗新冠药物的市场空间,为FB2001的未来销售提供额外的增长动力。
盈利预测与风险提示
财务业绩预测
根据预测,前沿生物在未来几年内将继续投入研发,因此短期内仍将面临盈利压力。预计2021年至2023年的营业收入分别为7000万元、1.4亿元和2.4亿元,呈现逐年增长趋势。然而,归属于母公司净利润预计分别为-2.0亿元、-1.7亿元和-1.0亿元,每股收益(EPS)分别为-0.55元、-0.47元和-0.28元,表明公司在预测期内仍处于亏损状态,但亏损幅度有望逐步收窄。
主要风险提示
报告提示了公司面临的主要风险:一是艾可宁(公司另一主要产品)的市场推广可能不及预期,影响公司现有产品的销售收入;二是FB2001或其他在研管线的研发进展可能不及预期,包括临床试验失败、审批延迟等,这将直接影响公司未来的产品上市和盈利能力。
总结
本报告分析指出,前沿生物的抗新冠药物FB2001获得临床试验批准,是公司发展的重要里程碑。该药物凭借与辉瑞Paxlovid相同的蛋白酶抑制机制,以及在体外和动物实验中展现出的优异活性,具备强大的市场潜力。FB2001在国内同机制新药中处于领先地位,且全球竞争格局良好,有望在疫情常态化背景下,抓住国内抗新冠药物的刚性需求和国家战略储备机遇。尽管公司短期内仍面临盈利挑战,但FB2001的成功研发和商业化将为前沿生物带来显著的长期增长空间。投资者需关注艾可宁的市场推广及FB2001的研发进展,以评估相关风险。
-

利润扭亏为盈,糖尿病治疗矩阵进一步丰富
-

医药行业周报:创新药板块利好频现、Q2多项大会值得期待,持续关注创新药、脑机接口、AI医疗
-

医药行业创新药周报:2026年2月第二周创新药周报
-

化工行业2026年投资策略:周期破晓,材料乘风
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送