-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

VV116取得新进展:国际III期临床试验完成首例患者给药,I期临床数据发表
VV116取得新进展:国际III期临床试验完成首例患者给药,I期临床数据发表
-
下载次数:
697 次
-
发布机构:
天风证券股份有限公司
-
发布日期:
2022-03-17
-
页数:
4页
君实生物(688180)
事件:近日,1)君实生物控股子公司君拓生物与旺山旺水合作开发的口服核苷类抗SARS-CoV2药物VV116片已启动一项在中重度新型冠状病毒肺炎受试者中评价VV116对比标准治疗的有效性和安全性的国际多中心、随机、双盲、对照III期临床研究,并已完成首例患者入组及给药。2)VV116已完成的三项I期临床结果发表在学术杂志ActaPharmacologicaSinica(IF:6.15)上,该项研究结果显示,VV116在健康受试者中表现出良好的安全性和耐受性和药代动力学性质。
新冠口服药VV116已启动2项国际多中心III临床试验,进度领先
目前,君实生物已分别开展针对轻中度以及中重度COVID-19患者的国际III期临床试验,在中国药企中君实生物进度较快。本次针对中重症患者的试验主要终点为截至第29天进展为(危)重型COVID-19或全因死亡的受试者百分比。此前,VV116已完成1项在中、重度COVID-19受试者中进行的随机、开放、对照II期临床试验,试验显示VV116具有很好的安全性和有效性,并且VV116已获得乌兹别克斯坦紧急使用授权(EUA)。VV116整体临床研究进度推进迅速,药物有望未来顺利实现商业化,满足反复发酵的新冠疫情的临床需求。
VV116完成三个I期临床,具有良好的安全性和耐受性
VV116完成了总计三个位于中国的I期临床试验,共入组86人。其中研究1和研究2为单剂量和多剂量递增研究,用于评估在健康受试者中单次和多次递增口服VV116的安全性、耐受性和药代动力学特征;研究3用于观察饮食对健康受试者口服VV116后药代动力学和安全性的影响。药物代谢方面,VV116在口服进入人体后迅速水解至其代谢物116-N1(母体核苷),血浆116-N1浓度快速达到峰值(中位Tmax1.00-2.50小时)。安全性方面,3个试验均无无死亡、严重不良事件(SAE)、3级或以上AE,或导致停药/中断的AE报告,并且所有AE均在没有任何治疗或干预的情况下恢复。
VV116具有结构优势,临床前结果良好
VV116是根据Remdesivir改造而来的RdRp抑制剂。在临床前药效学上,VV116在体内外都展现出显着的抗新冠病毒作用。在小鼠模型上,VV116以默沙东molnupiravir为阳性对照,研究发现在使用药物后,可将病毒滴度降低至检测限以下,抗新冠病毒的功效较强。同时VV116在动物毒性研究中未观测到不良反应,展现了较好的安全性。在药代动力学上,VV116具有很高的口服生物利用度,其口服吸收后,迅速代谢为母体核苷。药代性质是VV116有别于remdesivir最明显的特征之一,也是VV116口服有效的关键科学依据。
同时布局3CLpro抑制剂在研药物VV993,两药有望协同联用
公司与旺山旺水合作开发的还有另一款口服抗新冠病毒候选新药VV993。VV993是公司布局的与辉瑞Paxlovid相同机制的3CLpro抑制剂。目前根据VV993的临床前研究和抗病毒研究研究结果,VV993单药即显示出良好的有效性和安全性,具有重要的开发价值。与此同时,VV116和VV993是针对病毒生命周期的不同关键且保守靶点而开发的药物或候选药物,除了单药使用发挥各自的优势外,还具有联合用药的发展前景。
盈利预测与投资评级
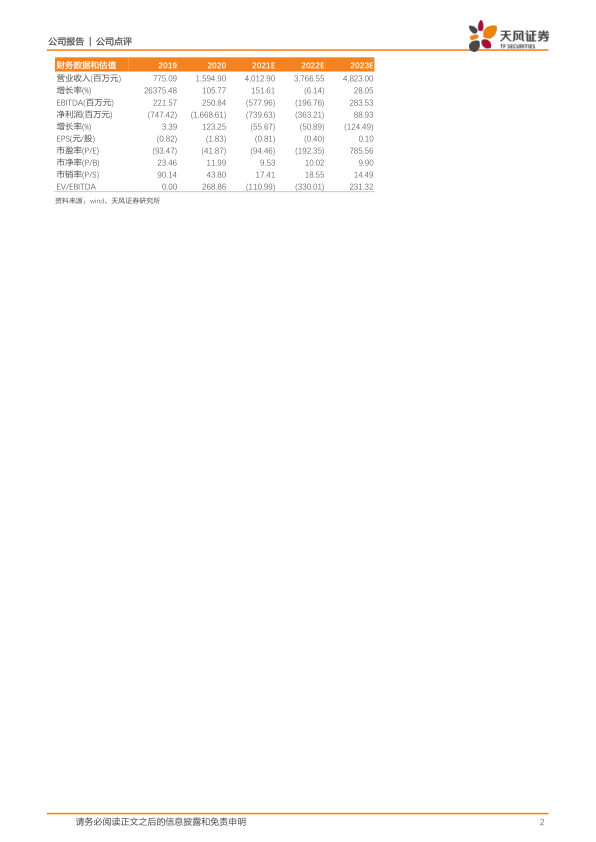
根据公司2021年业绩快报,我们将2021年收入由34.05亿上调至40.13亿,净利润由-2.48亿下调至-7.40亿元。我们预计2022至2023年收入为37.67、48.23亿元,实现归母净利润-3.63、0.9亿元。维持“买入”评级。
风险提示:临床试验失败风险,上市后销售不及预期,业绩快报为初步测算,具体数据以公司披露的正式年报为准
中心思想
本报告主要分析了君实生物在研新冠口服药VV116的最新进展,并探讨了其市场前景。
VV116研发进展及潜力
- 临床试验进展: VV116已启动针对中重度COVID-19患者的国际多中心III期临床试验,并在乌兹别克斯坦获得紧急使用授权,显示出较快的研发速度和潜在的商业化前景。
- 安全性与耐受性: I期临床试验结果表明,VV116在健康受试者中表现出良好的安全性和耐受性,为其后续临床开发奠定了基础。
盈利预测与投资评级
- 维持“买入”评级: 尽管调整了2021年的收入和净利润预测,但维持对君实生物的“买入”评级,显示对其未来发展的信心。
- 风险提示: 报告也提示了临床试验失败、上市后销售不及预期等风险,提醒投资者注意。
主要内容
事件
- VV116国际III期临床试验启动: 君实生物与旺山旺水合作开发的口服核苷类抗新冠病毒药物VV116已启动一项国际多中心III期临床研究,评估其在中重度新型冠状病毒肺炎受试者中的有效性和安全性。
- VV116 I期临床数据发表: VV116已完成的三项I期临床结果发表在学术杂志Acta Pharmacologica Sinica上,结果显示VV116在健康受试者中表现出良好的安全性和耐受性以及药代动力学性质。
新冠口服药VV116已启动2项国际多中心III临床试验,进度领先
- 临床试验进度: 君实生物已分别开展针对轻中度和中重度COVID-19患者的国际III期临床试验,进度在中国药企中处于领先地位。
- VV116临床数据及授权: VV116已完成一项在中、重度COVID-19受试者中进行的随机、开放、对照II期临床试验,试验显示VV116具有很好的安全性和有效性,并且已获得乌兹别克斯坦紧急使用授权(EUA)。
VV116完成三个I期临床,具有良好的安全性和耐受性
- I期临床试验设计: VV116完成了总计三个位于中国的I期临床试验,共入组86人,评估了单次和多次递增口服VV116的安全性、耐受性和药代动力学特征,以及饮食对药物代谢的影响。
- 安全性数据: 3个试验均未出现死亡、严重不良事件(SAE)、3级或以上AE,或导致停药/中断的AE报告,并且所有AE均在没有任何治疗或干预的情况下恢复。
VV116具有结构优势,临床前结果良好
- 作用机制: VV116是根据Remdesivir改造而来的RdRp抑制剂,在临床前药效学上,VV116在体内外都展现出显著的抗新冠病毒作用。
- 临床前数据: 在小鼠模型上,VV116可将病毒滴度降低至检测限以下,抗新冠病毒的功效较强,且在动物毒性研究中未观测到不良反应,展现了较好的安全性。
同时布局3CLpro抑制剂在研药物VV993,两药有望协同联用
- VV993研发: 公司与旺山旺水合作开发的还有另一款口服抗新冠病毒候选新药VV993,VV993是公司布局的与辉瑞Paxlovid相同机制的3CLpro抑制剂。
- 联合用药前景: VV116和VV993是针对病毒生命周期的不同关键且保守靶点而开发的药物或候选药物,除了单药使用发挥各自的优势外,还具有联合用药的发展前景。
盈利预测与投资评级
- 盈利预测调整: 根据公司2021年业绩快报,调整了2021年的收入和净利润预测。
- 维持“买入”评级: 维持“买入”评级。
总结
本报告对君实生物在研新冠口服药VV116的最新进展进行了分析,认为其临床试验进度领先,具有良好的安全性和耐受性,并具备潜在的商业化前景。同时,公司也在积极布局其他抗新冠药物,有望形成协同效应。维持对君实生物的“买入”评级,但同时也提示了相关风险。
-

天风医药细分领域分析与展望(2025H1):体外诊断行业及个股2025半年度回顾与展望
-

国内短期承压,海外市场呈现良好增长态势
-

基础化工行业研究周报:国家发改委,支持石化化工行业节能降碳改造,煤化工项目低碳化改造,双氧水、硫酸铵价格上涨
-

化工行业运行指标跟踪:2025年8-9月数据
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送