-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

定增完成募资近38亿,为在研候选药物补充现金流
定增完成募资近38亿,为在研候选药物补充现金流
-
下载次数:
1853 次
-
发布机构:
天风证券股份有限公司
-
发布日期:
2022-12-13
-
页数:
4页
君实生物(688180)
事件:
近日,公司发布公告2022年度向特定对象发行A股股票发行承销总结报告相关文件已经上海证券交易所备案通过。公司本次发行新增股份在中国证券登记结算有限责任公司上海分公司办理完成登记托管及限售手续。
点评:
完成大额定增募资,公司获充沛现金储备
本次定增完成,为君实生物的研发和发展提供充沛现金流。截至2022年11月23日止,君实生物本次定增发行价格为53.95元/股,实际募集资金总额为人民币37.765亿元。募集资金将用于创新药研发项目和上海君实生物科技总部及研发基地项目。其中创新药研发项目包括特瑞普利单抗(JS001)后续境内外临床研发、JS004(抗BTLA单抗)境内外III期临床研发等临床研发项目以及其他早期项目的临床前研究。
特瑞普利单抗销售额保持增长,商业化顺利推进
公司目前共有三款商业化品种:特瑞普利单抗、埃特司韦单抗(JS016)及阿达木单抗,商业化团队已超过1100人。2022Q1-Q3,核心产品特瑞普利单抗收入达5.16亿元,其中一季度环比增长约212%,二季度受疫情影响,环比增长约70%,三季度环比增长16%。2022年9月,特瑞普利单抗联合培美曲塞和铂类适用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的一线治疗新适应症获得国家药品监督管理局(NMPA)批准,是在中国获批的第六项适应症,治疗领域拓展到肺癌。2022年11月15日公司宣布特瑞普利单抗用于NPC和ESCC一线治疗在欧州药品管理局(EMA)完成提交,并在11月24日宣布向英国药品和保健品管理局(MHRA)完成上述两项适应症的上市申请的提交。特瑞普利单抗目前已在欧洲地区完成两项上市申请的提交,全球商业化布局继中美后开始向欧洲拓展,工作稳步前进。
新冠小分子口服在研药物VV116两项注册性III期临床正在进行
VV116正在国内外开展包括针对标准风险轻中度患者和伴随进展高风险轻中度患者两项注册性III期临床试验。针对标准风险人群的III期临床试验(NCT05582629),计划入组人数1200人。针对高风险人群的III期临床试验(NCT05242042),计划入组人数1310人。已经完成的I期药物临床试验表明,VV116在健康受试者中表现出良好的安全性、耐受性与药代动力学特征:在感染奥密克戎的患者人群中,开始用药到核酸转阴平均3.52天;首次核酸检测阳性5日内使用VV116的患者核酸转阴平均时间8.56天,小于对照组的11.13天。VV116与PAXLOVID头对头III期注册临床研究(NCT05341609)结果显示,首次核酸转阴时间VV116组与Paxlovid组相似,VV116组中位至持续临床恢复时间较PAXLOVID组更短,达到统计学优效。并且VV116总体安全性良好,总体不良事件发生率低于PAXLOVID。
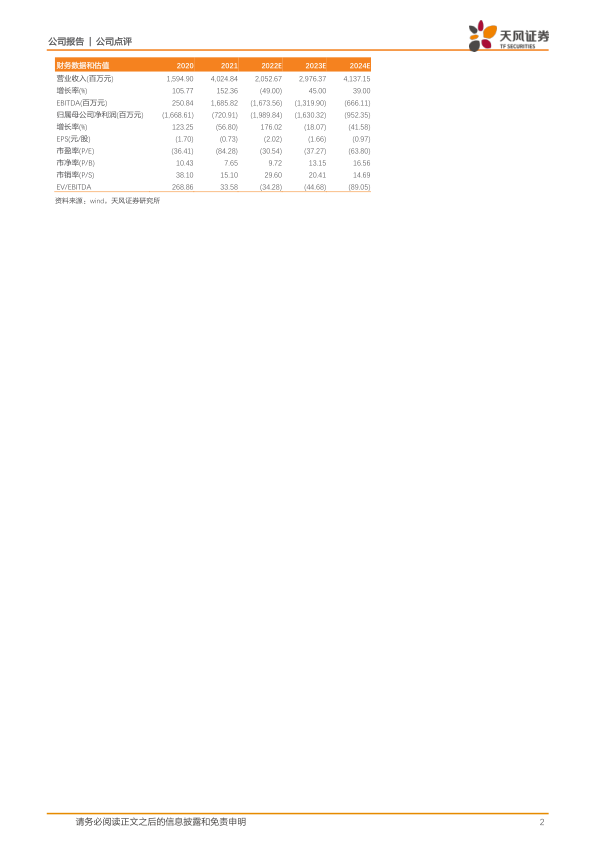
盈利预测与投资评级
考虑到医药行业整体销售放量受多项因素影响有所放缓,我们将公司2022至2024年营业收入由27.50亿、32.51亿、43.68亿元下调至20.53亿、29.76亿、41.37亿元,将归母净利润由-5.92亿、-4.94亿、-3.08亿元下调至-19.90亿、-16.30亿、-9.52亿元。维持“买入”评级。
风险提示:医保政策变动风险,研发不及预期风险,竞争加剧风险,审批进度不及预期风险,销售放量不及预期风险
中心思想
本报告主要分析了君实生物在2022年12月12日的公司发展情况,核心观点如下:
- 定增募资成功,现金流充裕: 君实生物成功完成近38亿元的定向增发,为创新药研发项目和总部研发基地提供了充足的资金支持,增强了公司的研发实力和发展潜力。
- 核心产品销售增长,商业化稳步推进: 特瑞普利单抗销售额持续增长,新适应症获批,并积极拓展海外市场,商业化团队不断壮大,为公司带来稳定的收入来源。
- 新冠药物临床进展顺利,安全性良好: 在研新冠小分子口服药物VV116的III期临床试验进展顺利,初步数据显示其疗效与PAXLOVID相似,且安全性更优,有望成为新的治疗选择。
主要内容
完成大额定增募资,公司获充沛现金储备
- 定增完成情况: 君实生物以53.95元/股的价格完成定向增发,实际募集资金总额为人民币37.765亿元,资金将主要用于创新药研发项目和上海君实生物科技总部及研发基地项目。
- 研发项目投入: 创新药研发项目包括特瑞普利单抗(JS001)后续境内外临床研发、JS004(抗BTLA单抗)境内外III期临床研发等临床研发项目以及其他早期项目的临床前研究。
特瑞普利单抗销售额保持增长,商业化顺利推进
- 商业化团队建设: 公司目前共有三款商业化品种:特瑞普利单抗、埃特司韦单抗(JS016)及阿达木单抗,商业化团队已超过1100人。
- 销售额增长情况: 2022Q1-Q3,核心产品特瑞普利单抗收入达5.16亿元,其中一季度环比增长约212%,二季度受疫情影响,环比增长约70%,三季度环比增长16%。
- 适应症拓展及海外布局: 特瑞普利单抗联合培美曲塞和铂类一线治疗非小细胞肺癌的新适应症获批,治疗领域拓展到肺癌。同时,公司在欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)完成提交了用于NPC和ESCC一线治疗的上市申请,全球商业化布局稳步推进。
新冠小分子口服在研药物VV116两项注册性III期临床正在进行
- 临床试验进展: VV116正在国内外开展针对标准风险轻中度患者和伴随进展高风险轻中度患者的两项注册性III期临床试验,计划入组人数分别为1200人和1310人。
- 临床数据表现: 已经完成的I期药物临床试验表明,VV116在健康受试者中表现出良好的安全性、耐受性与药代动力学特征。在感染奥密克戎的患者人群中,开始用药到核酸转阴平均3.52天;首次核酸检测阳性5日内使用VV116的患者核酸转阴平均时间8.56天,小于对照组的11.13天。
- 头对头研究结果: VV116与PAXLOVID头对头III期注册临床研究结果显示,首次核酸转阴时间VV116组与Paxlovid组相似,VV116组中位至持续临床恢复时间较PAXLOVID组更短,达到统计学优效。并且VV116总体安全性良好,总体不良事件发生率低于PAXLOVID。
盈利预测与投资评级
- 盈利预测调整: 考虑到医药行业整体销售放量受多项因素影响有所放缓,将公司2022至2024年营业收入和归母净利润进行了下调。
- 维持“买入”评级: 维持“买入”评级。
风险提示
- 医保政策变动风险
- 研发不及预期风险
- 竞争加剧风险
- 审批进度不及预期风险
- 销售放量不及预期风险
总结
本报告对君实生物近期的发展情况进行了全面分析。公司成功完成大额定增,为研发和发展提供了充足的资金保障。核心产品特瑞普利单抗销售额持续增长,商业化进展顺利,并积极拓展海外市场。在研新冠小分子口服药物VV116的临床试验数据表现良好,有望成为新的增长点。尽管考虑到行业因素对公司盈利预测进行了调整,但维持“买入”评级。投资者应关注医保政策、研发进展、市场竞争等风险因素。
-

天风医药细分领域分析与展望(2025H1):体外诊断行业及个股2025半年度回顾与展望
-

国内短期承压,海外市场呈现良好增长态势
-

基础化工行业研究周报:国家发改委,支持石化化工行业节能降碳改造,煤化工项目低碳化改造,双氧水、硫酸铵价格上涨
-

化工行业运行指标跟踪:2025年8-9月数据
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送