-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

加速后期管线研发,强化核心产品持续发力
加速后期管线研发,强化核心产品持续发力
-
下载次数:
2963 次
-
发布机构:
天风证券股份有限公司
-
发布日期:
2023-11-20
-
页数:
4页
君实生物(688180)
事件
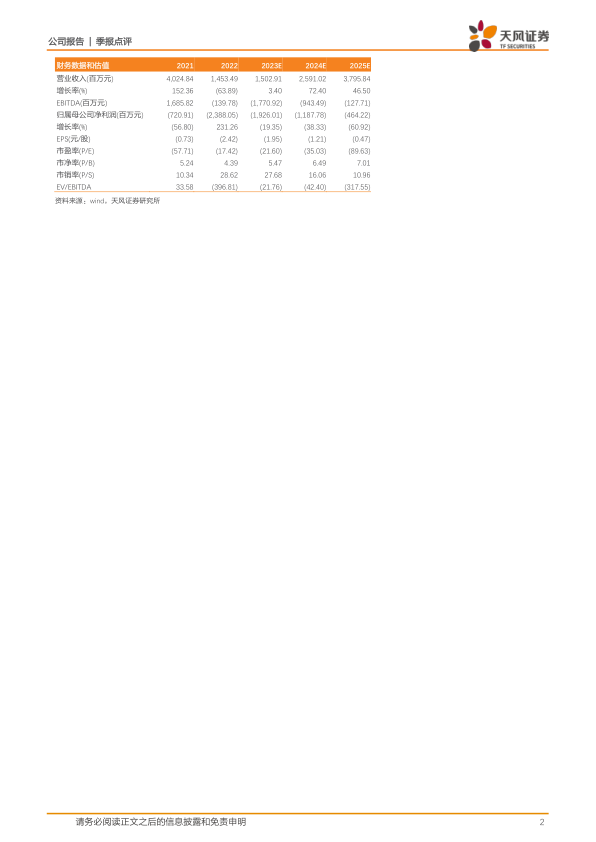
近日,公司发布了2023年第三季度报告。前三季度营业收入为9.86亿元,同比下降19.04%;归母净利润为-14.07亿元,同比减亏11.78%;扣非归母净利润为-13.59亿元,同比减亏17.46%。单三季度公司实现营业收入3.17亿元,同比增长16.31%;归母净利润为-4.09亿元,同比减亏39.998%;扣非归母净利润-3.88亿元,同比减亏44.62%。
药品销售收入持续增长,公司造血能力进一步强化
公司的主要营业收入来源于药品销售,截至2023年前三季度,特瑞普利单抗实现了大约6.68亿元的销售收入,同比增长约29.7%。氢溴酸氘瑞米德韦片取得了1.24亿元的销售收入,特别是在2023年第二季度,受疫情发展趋势的推动,销售额实现了显著增长。自2023年4月1日价格调整以来,该产品继续暂时纳入医保支付范围,进一步促进了销售的发展。阿达木单抗实现了销售收入9940万元。
特瑞普利单抗数据读出高效完成,海外批准进展顺利
今年上半年,特瑞普利单抗在Ⅲ期研究中取得了重要进展:Neotorch(1月)、TORCHLIGHT(2月)、RENOTORCH(4月)和EXTENTORCH(5月)、NCT05342194(6月)。同时,该药品在新适应症方面的上市申请也已被中国NMPA受理,包括非小细胞肺癌围手术期(4月)、三阴性乳腺癌(5月)、肾细胞癌1L(7月)以及小细胞肺癌1L(7月)。公司在9月宣布特瑞普利单抗在一线治疗黑色素瘤的III期临床研究取得关键的成功,mPFS获益显著,成为国内首个PD-(L)1抑制剂一线治疗晚期黑色素瘤的注册临床研究达成阳性结果的案例。在海外市场,公司已经在全球范围内(包括中国、美国、东南亚以及欧洲等地)启动了40多项由公司发起的临床研究,覆盖超过15个不同适应症。此外,美国FDA已完成对公司国内生产基地的现场核查,并批准上市,同时特瑞普利单抗在英国和欧盟的上市申请也正在审评中。
公司后期研发项目加速推进,成长动能蓄势待发
昂戈瑞西单抗的上市申请已被NMPA受理,涵盖适应症包括原发性高胆固醇血症(杂合子型家族性和非家族性)以及混合型血脂异常,还包括用于成人或12岁以上青少年的纯合子型家族性高胆固醇血症。此外,FIC在研药物tifcemalimab已获准进行国际多中心Ⅲ期临床研究,这是BTLA靶点药物首个确证性研究。JS005用于治疗中重度斑块状银屑病已进入Ⅲ期阶段,强直性脊柱炎方面已启动注册临床试验的沟通交流。另外,JS207(抗PD-1和VEGF双特异性抗体)的临床试验申请已获国家药监局批准,并已完成首例受试者的给药。
盈利预测与投资评级
考虑到公司三季度财务数据以及后续放量预期,我们将公司2023至2025的预期营业收入由20.40亿、29.24亿、37.40亿调整为15.02亿、25.91亿、37.96亿元人民币,预期归母净利润由-10.34亿、-6.34亿、-4.96亿调整为-19.26亿、-11.88亿、-4.64亿元人民币。维持“买入”评级。
风险提示:经营风险,在研药物研发失败风险,政策变动风险,市场竞争加剧风险
中心思想
本报告对君实生物2023年第三季度报告进行了分析,核心观点如下:
- 药品销售增长与盈利改善: 公司药品销售收入持续增长,尤其是特瑞普利单抗和氢溴酸氘瑞米德韦片,推动公司造血能力进一步强化,单季度及前三季度均实现同比减亏。
- 研发管线加速与海外进展: 特瑞普利单抗多项临床研究取得进展,适应症上市申请获受理,海外市场也在积极推进,后期研发项目加速,为公司未来成长蓄势。
- 维持“买入”评级: 尽管调整了公司未来几年的营收和利润预期,但维持“买入”评级,看好公司未来的发展潜力。
主要内容
公司业绩表现
- 营收与利润分析: 公司前三季度营业收入同比下降,但归母净利润同比减亏。单三季度营业收入同比增长,归母净利润同比大幅减亏,显示出盈利能力的改善。
- 药品销售收入分析: 特瑞普利单抗销售收入同比增长显著,氢溴酸氘瑞米德韦片销售额受疫情推动实现增长,阿达木单抗也贡献了可观的销售收入。
核心产品特瑞普利单抗
- 临床研究进展: 特瑞普利单抗在多个Ⅲ期研究中取得重要进展,多个新适应症的上市申请已被中国NMPA受理。
- 海外市场拓展: 公司在全球范围内启动了多项临床研究,美国FDA已完成对公司国内生产基地的现场核查并批准上市,欧洲和英国的上市申请也在审评中。
后期研发管线
- 新药上市申请: 昂戈瑞西单抗的上市申请已被NMPA受理,适应症包括高胆固醇血症和混合型血脂异常。
- 在研药物进展: FIC在研药物tifcemalimab已获准进行国际多中心Ⅲ期临床研究,JS005用于治疗中重度斑块状银屑病已进入Ⅲ期阶段,JS207(抗PD-1和VEGF双特异性抗体)的临床试验申请已获批并完成首例受试者给药。
盈利预测与投资评级
- 盈利预测调整: 基于公司三季度财务数据和后续放量预期,调整了公司2023-2025年的营业收入和归母净利润预期。
- 维持投资评级: 维持“买入”评级,显示对公司未来发展的信心。
总结
本报告对君实生物2023年第三季度报告进行了深入分析,指出公司药品销售收入持续增长,盈利能力有所改善。特瑞普利单抗作为核心产品,在临床研究和海外市场拓展方面均取得重要进展。公司后期研发管线也在加速推进,为未来的发展提供了充足的动力。尽管调整了盈利预测,但维持“买入”评级,表明对公司长期发展前景的看好。投资者应关注公司经营风险、在研药物研发失败风险、政策变动风险以及市场竞争加剧风险。
-

天风医药细分领域分析与展望(2025H1):体外诊断行业及个股2025半年度回顾与展望
-

国内短期承压,海外市场呈现良好增长态势
-

基础化工行业研究周报:国家发改委,支持石化化工行业节能降碳改造,煤化工项目低碳化改造,双氧水、硫酸铵价格上涨
-

化工行业运行指标跟踪:2025年8-9月数据
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送