-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

自免广阔天地,新星展智飞翔
自免广阔天地,新星展智飞翔
-
下载次数:
295 次
-
发布机构:
西南证券股份有限公司
-
发布日期:
2023-09-28
-
页数:
56页
智翔金泰(688443)
投资要点
推荐逻辑:1)GR1501为首个提交NDA国产IL-17A单抗,中重度斑块状银屑病患者超110万,中轴型脊柱关节炎等适应症也处于后期临床,国内潜在销售峰值达30亿元;2)IL-4A单抗研发进度位于国内第一梯队,2023年内有望开展Ⅲ期临床,中重度特应性皮炎超1800万患者,国内潜在销售峰值达36亿元;3)抗狂犬病毒双抗处于Ⅲ期临床,有望免疫球蛋白用于暴露后预防,国内潜在销售峰值达11亿元。
GR1501为首个提交NDA的国产IL-17A单抗。公司III期临床试验随访显示,试验达到主要临床终点。200mgQ4W维持治疗,第24周达到PASI75受试者比例为98.6%、达到PGA(0~1)受试者比例为84.4%。达到PASI75受试者比例优于司库奇尤单抗等已上市生物制剂。24周疗效数据显示长期用药可持续提高治疗效果。2023年3月25日,赛立奇单抗注射液NDA获受理。
IL-4单抗有望年内开展Ⅲ期临床,研发进度位于国产第一梯队。I期临床显示,受试者单次皮下注射GR1802注射液75-900mg,安全性和耐受性良好,免疫原性良好。各试验组受试者在第15天的血清II型炎症生物标志物TARC浓度均较基线降低。国内共有12款特应性皮炎适应症生物制品在研,GR1802研发进度较为领先,中重度特应性皮炎适应症预计2026年获批上市。Ib、II期临床试验在2022年2月完成受试者入组,预计2023年四季度开展III期临床试验。
优异在研管线,有望成为国内自免生物药龙头。公司共有12个在研产品,8个产品(15个适应症)获批进入临床研究,其中赛立奇单抗(GR1501)针对中重度斑块状银屑病适应症已于2023年3月提交NDA,放射学阳性中轴型脊柱关节炎适应症已完成III期临床入组;GR1801疑似狂犬病病毒暴露后的被动免疫适应症已进入III期临床阶段;GR1802哮喘、中重度特应性皮炎、慢性自发性荨麻疹和慢性鼻窦炎伴鼻息肉适应症及GR1603系统性红斑狼疮适应症处于II期临床试验阶段;其余4个产品(7个适应症)处于I期临床试验阶段。
盈利预测与估值。预计公司2023-2025年实现营业收入分别约为0、1.2、4.6亿元。考虑公司研发实力强劲,自身免疫疾病市场广阔,首款创新药GR1801已提交NDA,DCF估值法测算公司管线估值约为141.7亿元,对应目标价38.64元,首次覆盖给予“买入”评级。
风险提示:研发失败风险、商业化不及预期风险、行业政策风险。
中心思想
核心竞争力与市场定位
智翔金泰作为一家创新驱动型生物制药企业,凭借其在新型噬菌体呈现系统和双特异性抗体药物发现平台等方面的源头创新能力,构建了涵盖自身免疫性疾病、感染性疾病和肿瘤等多个高价值领域的丰富在研管线。公司核心产品GR1501(IL-17A单抗)已成为首个提交新药上市申请(NDA)的国产同类药物,GR1802(IL-4Rα单抗)和GR1801(抗狂犬病毒双抗)的研发进度也位居国内第一梯队。在实际控制人智飞生物掌门人蒋仁生及经验丰富的管理团队带领下,智翔金泰有望凭借其领先的研发实力和差异化的产品优势,在国内自免生物药市场中占据重要地位。
广阔市场前景与估值潜力
报告深入分析了中国自身免疫性疾病(包括银屑病、系统性红斑狼疮、特应性皮炎)和狂犬病被动免疫市场的巨大未满足需求和快速增长潜力。例如,中国银屑病患者人数预计2030年将达到约685万人,特应性皮炎患者人数预计2030年增至8170万人,狂犬病病毒暴露患者每年约4000万人。这些庞大的患者群体和不断提升的生物药渗透率,为智翔金泰的核心产品提供了广阔的市场空间。通过DCF估值法测算,公司核心管线产品GR1501、GR1802、GR1801的销售峰值分别预计达30.3亿元、36.2亿元和11.6亿元,总估值约为141.7亿元,对应目标价38.64元,首次覆盖给予“买入”评级,凸显了其显著的估值提升潜力。
主要内容
1. 自免领域新星,感染性疾病和肿瘤齐头并进
1.1 实控人为疫苗龙头智飞生物掌门人,管理团队经验丰富
智翔金泰是一家专注于自身免疫性疾病、感染性疾病和肿瘤治疗领域的创新驱动型生物制药企业。公司实际控制人蒋仁生同时也是国内疫苗龙头智飞生物的掌门人,通过智睿投资和智飞生物间接控制公司。公司管理团队经验丰富,董事长单继宽曾联合创办君实生物,具有深厚的创新药行业背景。稳定的股权结构和专业的管理团队为公司的长期发展奠定了坚实基础。
1.2 专注源头创新,重点搭建了多个先进药物发现平台
智翔金泰在源头创新方面投入巨大,建立了多个先进药物发现平台,包括基于新型噬菌体呈现系统的单抗药物发现技术平台和双特异性抗体药物发现技术平台。其独有的λ重组系统抗体库构建技术平台,能够在一周内获得库容量超过10^11的重组抗体库,一个月内可达10^12,显著提高了抗体库构建效率,将抗体药物候选分子的发现周期缩短至6-9个月。此外,公司还开发了双载体噬菌体呈现抗体库技术(已获发明专利授权)和两种结构的双特异性抗体开发技术平台(scFv+Fab和共同轻链Fab+Fab),为后续产品开发提供了强大的技术支撑。
1.3 在研管线拥有涵盖自免、感染、肿瘤等领域 12个高价值产品
公司拥有12个主要在研产品,其中8个产品(涵盖15个适应症)已获批进入临床研究阶段。核心产品包括:
- GR1501(赛立奇单抗):针对中重度斑块状银屑病适应症已于2023年3月提交新药上市申请(NDA),是国内首家提交NDA的抗IL-17单克隆抗体;放射学阳性中轴型脊柱关节炎适应症已完成III期临床入组。
- GR1801(抗狂犬病病毒双抗):用于疑似狂犬病病毒暴露后的被动免疫,已进入III期临床试验阶段,是国内首个进入临床试验的抗狂犬病病毒G蛋白双抗。
- GR1802(抗IL-4Rα单抗):用于哮喘、中重度特应性皮炎、慢性自发性荨麻疹和慢性鼻窦炎伴鼻息肉等适应症,处于II期临床试验阶段,研发进度位于国产第一梯队。
- GR1603(抗IFNAR1单抗):用于系统性红斑狼疮适应症,处于II期临床试验阶段,是国内企业首家进入临床试验阶段的抗IFNAR1单克隆抗体药物。 公司计划未来三年积极推进GR1802、GR1501等产品的适应症拓展,GR1603、GR1803和GR1901等产品进入关键注册临床,并计划每年实现1-2个新产品进入临床阶段。同时,公司计划扩大生产规模,预计2024年和2025年分别新增20000L和30000L抗体药物产能,以提高商业化生产能力。
2. 自免广阔市场,竞争激烈强者为王
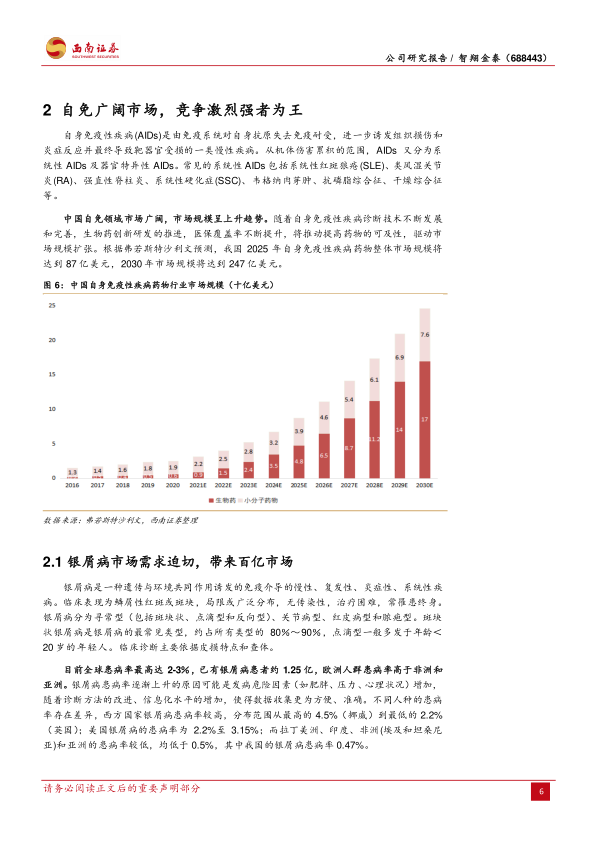
2.1 银屑病市场需求迫切,带来百亿市场
银屑病是一种免疫介导的慢性、复发性、炎症性皮肤病。全球患病率最高达2-3%,中国患病率约为0.47%,患者人数约为670万人,预计2030年将达到约685万人。全球银屑病药物市场规模在2020年达到253亿美元。中国银屑病药物市场规模在2019年约为90亿元,年均增长率约11.8%。自2021年起,生物制剂销售额显著高于化药,其中司库奇尤单抗在2022年样本医院销售占比超过65%,占据市场主导地位。《中国银屑病诊疗指南》(2022版)已将生物制剂推荐为中重度斑块状银屑病的一线治疗。IL-17A拮抗剂在临床有效性(如PASI75应答率)、患者持续使用率和安全性方面表现优异,尤其在中国乙型肝炎病毒、结核感染高发及心血管事件上升的背景下,IL-17A拮抗剂和IL-12/23拮抗剂的安全性优势使其有望取代传统药物成为银屑病的主流治疗方式。
2.2 系统性红斑狼疮市场基数庞大,临床需求有待解决
系统性红斑狼疮(SLE)是一种累及全身多系统、多脏器的自身免疫性疾病,具有高患病比例、高疾病负担、高并发症发生率和易复发等特点。根据弗若斯特沙利文数据,2019年中国SLE患病人口约100万人,预计2030年将达到约109万人。尽管现有治疗方案(如糖皮质激素、免疫抑制剂)能控制部分症状,但仍存在反应率不足(仅约25%患者达临床缓解)、复发风险高(4年内总复发风险高达60%)和副作用明显(激素相关不良反应发生率超30%)等未满足的临床需求。中国SLE药物市场规模在2020年约为3亿美元,预计2025年将增至16亿美元,其中生物药市场规模约11亿美元,并有望在2030年达到32亿美元,显示出巨大的增长潜力。贝利尤单抗(2019年上市)和泰它西普(BLyS和APRIL双靶点)等生物制剂的上市,正在推动市场发展,但仍需更多创新疗法来解决患者的长期治疗目标。
2.3 特应性皮炎缺乏有效、安全的治疗药物,IL-4R药物市场渗透率低
特应性皮炎(AD)是一种慢性、复发性、炎症性皮肤病,患者常伴有剧烈瘙痒,严重影响生活质量。中国特应性皮炎患者人数庞大,2019年已达到6570万人,预计2030年将增至8170万人。中国AD药物市场规模在2020年约为6.3亿美元,预计2030年将快速增长至43亿美元。传统的AD治疗方式主要依赖皮肤保湿润肤剂、外用类固醇或神经钙调蛋白抑制剂以及环孢菌素等,但缺乏有效且安全的长期治疗手段。2020年6月,IL-4R抗体药物度普利尤单抗注射液在国内上市,作为全球唯一上市的治疗特应性皮炎的生物制剂,其在2022年样本医院销售额达3.7亿元,同比增长170%。随着药品价格下降、适应症拓展和学术推广深入,中国IL-4Rα抗体市场预计2030年将达到40.8亿美元,但目前市场渗透率仍较低,预示着巨大的增长空间和未满足的临床需求。
3. 创新研发实力强劲,多款自免重磅产品处于国内第一梯队
3.1 GR1501:首个提交 NDA的国产IL-17A单抗,商业化在即
GR1501(赛立奇单抗)是智翔金泰自主研发的高亲和力、全人源(IgG4亚型)抗人IL-17A单克隆抗体,通过特异性结合血清中的IL-17A蛋白,阻断其与IL-17RA的结合,从而抑制炎症发生和发展。2023年3月25日,GR1501注射液的中重度斑块状银屑病适应症上市申请获得国家药监局受理,成为首款申报上市的国产抗IL-17A单抗。其III期临床试验随访数据显示,200mg Q4W维持治疗24周,PASI75应答率高达98.6%,PGA(0~1)应答率达84.4%,疗效优于部分已上市生物制剂。此外,GR1501用于治疗放射学阳性中轴型脊柱关节炎已处于III期临床试验阶段,预计2024年二季度提交上市申请,2025年三季度获批上市。鉴于司库奇尤单抗等IL-17A单抗在全球和中国市场的快速放量(2021年中国销售额约15亿元),GR1501有望在银屑病和中轴型脊柱关节炎治疗领域快速实现商业化。
3.2 GR1802:自主研发的重组全人源抗 IL-4Rα单克隆抗体
GR1802是智翔金泰自主研发的重组全人源抗IL-4Rα单克隆抗体,通过选择性结合IL-4Rα,同时阻断IL-4和IL-13信号通路,用于治疗哮喘、中重度特应性皮炎、慢性鼻窦炎伴鼻息肉和慢性自发性荨麻疹等II型免疫反应介导的过敏性疾病。临床前研究显示,GR1802对IL-4、IL-13信号传导有显著抑制活性,亲和力高、特异性强,动物模型药效显著且安全性良好。
- 特应性皮炎: GR1802中重度特应性皮炎适应症Ib、II期临床试验已完成受试者入组,预计2023年四季度开展III期临床试验,有望于2026年获批上市。目前国内至少有12款特应性皮炎适应症生物制品在研,GR1802处于国产第一梯队。
- 哮喘: 中国15岁及以上哮喘患者人数或超4800万,哮喘药物市场预计2030年将增至97亿美元。GR1802哮喘适应症预计在2024年一季度启动III期临床试验,有望填补现有治疗方案(如吸入或口服糖皮质激素)对中重度哮喘疗效不佳的临床空白。
- 慢性鼻窦炎伴鼻息肉: 中国慢性鼻窦炎患者人数于2019年达到1.2亿例,预计2030年增至1.4亿例,药物市场规模预计2030年达15.2亿美元。目前国内尚无用于治疗慢性鼻窦炎伴鼻息肉适应症的生物制品获批上市,GR1802处于II期临床,具有先发优势。
3.3 GR1603:系统性红斑狼疮新希望,国内首个进入 I期临床的抗IFNAR1单抗
GR1603是智翔金泰自主研发的重组全人源抗IFNAR1单克隆抗体,适用于系统性红斑狼疮(SLE)。SLE的发病与I型IFN/IFNAR信号通路的过度激活密切相关。GR1603通过特异性结合I型干扰素受体复合物中的IFNAR1,阻断I型干扰素的结合并诱导IFNAR1内化,从而有效抑制I型IFN/IFNAR信号通路。临床前研究显示,GR1603细胞活性高,显著拮抗I型IFN诱导的各种生物学活性,且安全性良好。目前GR1603处于Ib/II期临床试验阶段,是国内企业首家进入I期临床试验的抗IFNAR1单克隆抗体,预计2024年启动III期临床试验。鉴于中国SLE生物药市场巨大的增长潜力(预计2030年达32亿美元)和现有疗法存在的局限性,GR1603有望为SLE患者带来新的治疗希望。
3.4 GR1801:国内首个进入临床试验的抗狂犬病病毒 G蛋白双抗
中国每年疑似狂犬病病毒暴露患者数量巨大,约为4000万人,其中III级暴露约占40%。狂犬病致死率高,预防措施至关重要。“疫苗+被动免疫制剂”是狂犬病暴露后最有效的处置方式。然而,现有被动免疫制剂(如狂犬病人免疫球蛋白HRIG)存在来源和供应量有限、价格偏高以及血源传播疾病的潜在风险。GR1801是智翔金泰自主研发的重组全人源抗狂犬病病毒双特异性抗体,也是全球首个用于狂犬病被动免疫的双特异性抗体。它通过结合狂犬病病毒G蛋白上表位I和III,阻断G蛋白与受体的结合,在疫苗主动免疫发挥作用前提供即时保护。临床前研究显示,GR1801对多个毒株具有广谱中和活性,安全性良好,对多种亲缘性较远的狂犬病毒攻毒小鼠可实现100%保护。目前GR1801处于III期临床试验阶段,预计2025年四季度获批上市。中检院数据显示,狂犬病毒被动免疫制剂存量市场空间约为21亿元,GR1801作为不受血液制品限制、可批量生产的重组蛋白制品,具有广阔的市场空间。
4. 盈利预测与估值
4.1 盈利预测
基于对核心产品GR1501、GR1802和GR1801的销售预测,公司预计2023-2025年营业收入分别为0、1.2亿元和4.6亿元,归母净利润分别为-4亿元、-3.8亿元和-2.9亿元。
- GR1501: 假设上市首年(2023年)患者年用药费用约4.16万元,次年医保谈判降价50%。中性假设下,预计2034年销售峰值约30.3亿元。
- GR1802: 假设上市首年(预计2026年)价格约3500元/支,次年医保谈判降价50%。中性假设下,预计2034年销售峰值约36.2亿元。
- GR1801: 假设上市首年(预计2025年)价格约598元/
-

利润扭亏为盈,糖尿病治疗矩阵进一步丰富
-

医药行业周报:创新药板块利好频现、Q2多项大会值得期待,持续关注创新药、脑机接口、AI医疗
-

医药行业创新药周报:2026年2月第二周创新药周报
-

化工行业2026年投资策略:周期破晓,材料乘风
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送