-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

泽布替尼临床优效性持续验证,海内外加速放量
泽布替尼临床优效性持续验证,海内外加速放量
-
下载次数:
1177 次
-
发布机构:
西南证券股份有限公司
-
发布日期:
2022-10-21
-
页数:
4页
百济神州(688235)
事件:2022年]10月12日,公司宣布在全球3期ALPINE试验的一项终期分析中,经独立评审委员会(IRC)及研究者评估,百悦泽®(泽布替尼)对比亿珂®(伊布替尼),取得无进展生存期(PFS)的优效性结果。泽布替尼总体耐受性良好,本次分析显示的安全性结果与既往报告中一致。
泽布替尼ORR、PFS终点均优于泽布替尼,临床优效性持续验证。ALPINE是一项随机、全球3期临床试验(NCT03734016),旨在评估百悦泽®(泽布替尼)对比亿珂®(伊布替尼),用于治疗既往经治的复发或难治性慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的效果。2022年4月,公司宣布该研究的最终缓解评估结果,泽布替尼在由IRC评估的ORR展现相比伊布替尼的优效性。百悦泽对比伊布替尼ORR结果分别为80.4%和72.9%(双侧p值=0.0264)。此次公布的PFS最终分析结果持续验证了泽布替尼的临床优效性。
泽布替尼国内外快速放量,多项适应症国内外申报有序推进。基于此前SEQUOIA和ALPINE研究数据,2022年8月,美国NCCN公布CLL/SLL2023年V1版。2022CSCO指南中泽布替尼治疗CLL获全面I级推荐,此次更新使泽布替尼地位进一步提升,成为唯一获CSCO和NCCN指南双重优先推荐的BTK抑制剂。2022H1百悦泽®全球销售额15.1亿元(+263.1%),其中美国市场销售额10.2亿元(+504.2%),主要由于美国处方数量持续增长及临床医生在套细胞淋巴瘤(MCL)、华氏巨球蛋白血症(WM)和边缘区淋巴瘤(MZL)等获批适应症中使用增多;中国市场销售额4.6亿元(+83.5%),主要由于包括CLL、MCL和WM在内多个已获批适应症销售额持续增长,百悦泽国内获批三项适应症均已纳入国家医保目录。后续适应症上市申报顺利推进:美国:CLL/SLL适应症上市申请已获FDA受理,PDUFA目标时间为2023年1月;与奥妥珠单抗联合治疗既往接受过至少二线全身治疗后的复发或难治性滤泡性淋巴瘤(R/RFL)适应症获FDA“快速通道”资格;欧洲:泽布替尼针对CLL、MZL上市申请已获EMA受理,并分别于10月、9月获CHMP积极意见。
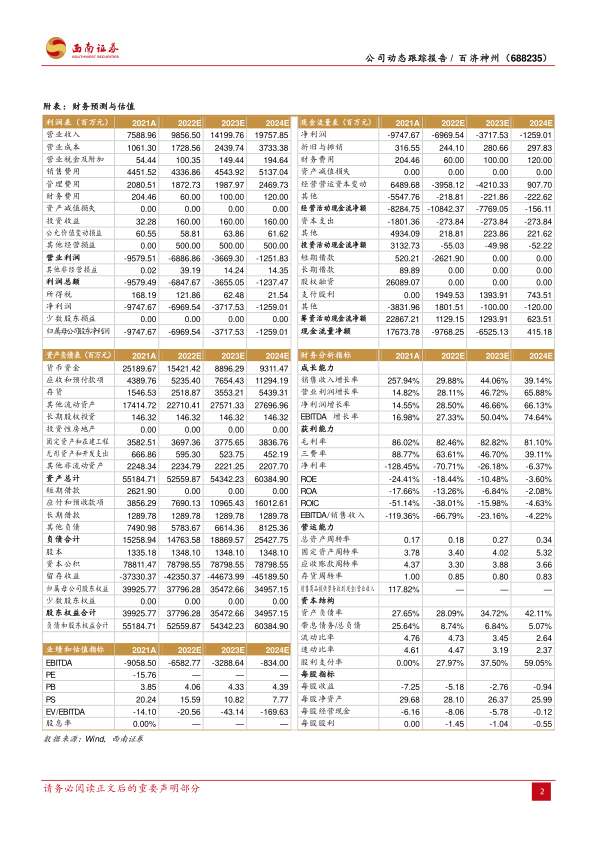
盈利预测与投资建议。预计2022-2024年EPS分别为-5.18元、-2.76元、-0.94元。考虑到百悦泽、百泽安和新产品快速放量,众多新增适应症处于申报或后期临床,后续在研管线储备充足,建议投资者积极关注。
风险提示:创新药研发、上市、商业化不达预期;药品降价风险。
中心思想
本报告主要围绕百济神州的核心产品泽布替尼的临床优效性及市场放量情况进行分析,并对公司未来盈利能力进行预测。
泽布替尼临床价值持续验证
泽布替尼在关键临床试验中展现出优于伊布替尼的疗效,尤其在无进展生存期(PFS)和客观缓解率(ORR)等关键指标上,巩固了其作为BTK抑制剂的领先地位。
国内外市场加速放量
泽布替尼凭借其临床优势和适应症的不断拓展,在全球市场销售额快速增长,尤其是在美国和中国市场。同时,公司积极推进新适应症的国内外申报,为未来的增长奠定基础。
主要内容
泽布替尼临床优效性持续验证
- ALPINE试验终期分析结果:百济神州宣布,在全球3期ALPINE试验的终期分析中,泽布替尼对比伊布替尼,在无进展生存期(PFS)方面取得优效性结果。安全性结果与既往报告一致,总体耐受性良好。
- ORR和PFS终点均优于伊布替尼:ALPINE试验结果显示,泽布替尼在IRC评估的ORR方面也优于伊布替尼,分别为80.4%和72.9%(双侧 p 值=0.0264)。
泽布替尼国内外快速放量,多项适应症国内外申报有序推进
- 国内外指南推荐:泽布替尼获得美国NCCN和中国CSCO指南的双重优先推荐,进一步提升了其市场地位。
- 全球销售额快速增长:2022H1百悦泽®全球销售额15.1亿元(+263.1%),其中美国市场销售额10.2亿元(+504.2%),中国市场销售额4.6亿元(+83.5%)。
- 适应症上市申报进展:CLL/SLL适应症上市申请已获FDA受理,PDUFA目标时间为2023年1月;与奥妥珠单抗联合治疗复发或难治性滤泡性淋巴瘤(R/R FL)适应症获FDA“快速通道”资格;泽布替尼针对CLL、MZL上市申请已获EMA受理,并分别于10月、9月获CHMP积极意见。
盈利预测与投资建议
- 盈利预测:预计2022-2024年EPS分别为-5.18元、-2.76元、-0.94元。
- 投资建议:考虑到百悦泽、百泽安和新产品快速放量,众多新增适应症处于申报或后期临床,后续在研管线储备充足,建议投资者积极关注。
总结
本报告通过对百济神州泽布替尼的临床数据和市场表现进行分析,验证了其临床优效性,并指出其在全球市场快速放量的趋势。同时,公司积极推进新适应症的申报,为未来的增长奠定基础。尽管公司目前仍处于亏损状态,但考虑到其产品管线的潜力和市场前景,建议投资者积极关注。
-

利润扭亏为盈,糖尿病治疗矩阵进一步丰富
-

医药行业周报:创新药板块利好频现、Q2多项大会值得期待,持续关注创新药、脑机接口、AI医疗
-

医药行业创新药周报:2026年2月第二周创新药周报
-

化工行业2026年投资策略:周期破晓,材料乘风
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送