-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

亚盛医药-B(06855):首次覆盖:厚积薄发,逐步迈向全球化Biopharma
亚盛医药-B(06855):首次覆盖:厚积薄发,逐步迈向全球化Biopharma
-
下载次数:
2336 次
-
发布机构:
海通国际
-
发布日期:
2024-10-10
-
页数:
37页
中心思想
全球化创新药企的崛起与核心管线驱动
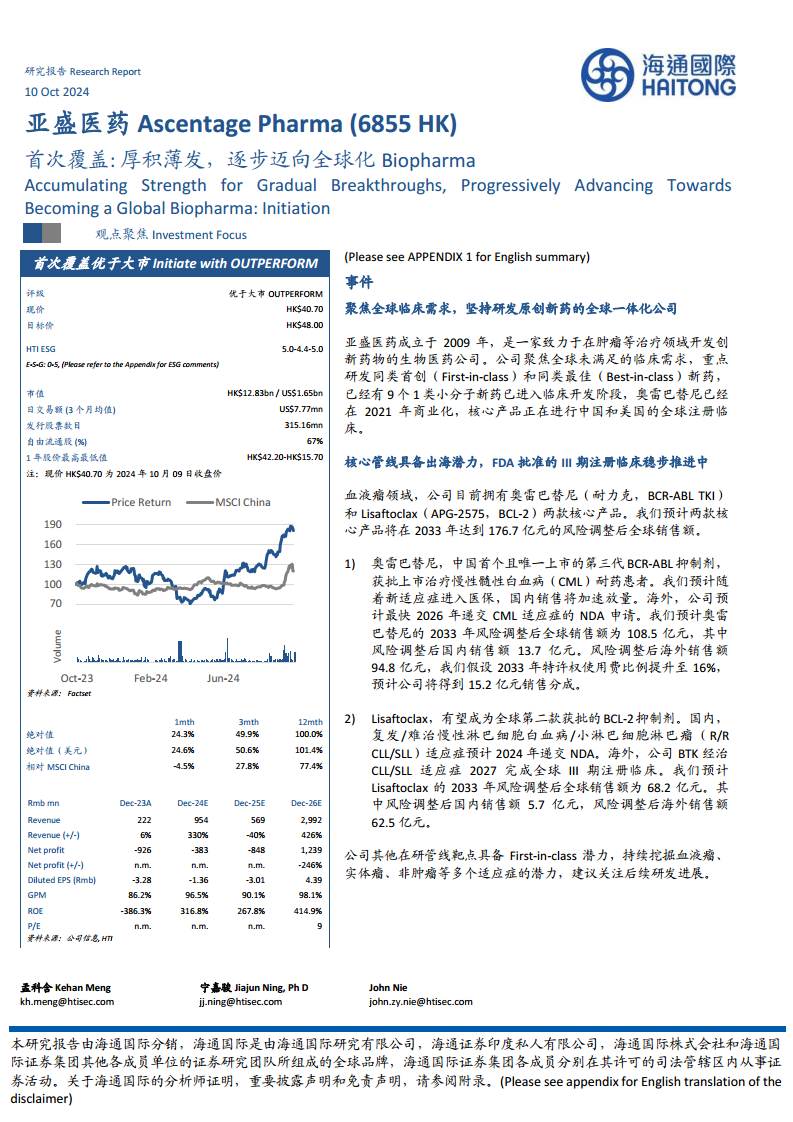
亚盛医药(Ascentage Pharma,6855 HK)作为一家全球一体化的生物医药公司,正逐步迈向全球化,致力于解决肿瘤等治疗领域未满足的临床需求。公司通过坚持原创新药研发,聚焦同类首创(First-in-class)和同类最佳(Best-in-class)药物,已构建起具有国际竞争力的产品管线。
- 创新研发与全球布局: 亚盛医药拥有9个1类小分子新药进入临床开发阶段,其中奥雷巴替尼已于2021年商业化。公司在全球范围内开展40多项I/II期临床试验和8项临床注册试验,其中2项获得FDA批准,并拥有520项授权专利,海外授权专利占比高达70.6%,显示出其强大的全球研发实力和国际化运营能力。
- 核心产品销售潜力巨大: 奥雷巴替尼(BCR-ABL TKI)和Lisaftoclax(APG-2575,BCL-2)是公司的两大核心产品。报告预计,到2033年,这两款产品将实现176.7亿元人民币的风险调整后全球销售额。奥雷巴替尼作为中国首个且唯一上市的第三代BCR-ABL抑制剂,预计2033年全球销售额将达108.5亿元;Lisaftoclax有望成为全球第二款获批的BCL-2抑制剂,预计2033年全球销售额将达68.2亿元。
- 财务状况显著改善与融资拓展: 2024年上半年,公司首次实现半年度盈利,净利润达1.6亿元人民币,营业收入8.2亿元,同比增长477%。这主要得益于与武田制药就奥雷巴替尼全球权益达成的BD交易,获得了1亿美元选择权付款和7500万美元股权投资。此外,公司已向美国证券交易委员会递表,计划赴美上市,进一步拓宽融资渠道,为中长期发展提供资金保障。
主要内容
亚盛医药的全球化战略与核心产品市场分析
1. 立足全球市场,坚持原创新药研发
亚盛医药成立于2009年,是一家专注于肿瘤、乙肝及衰老相关疾病治疗领域的生物医药公司。公司凭借自主构建的蛋白-蛋白相互作用靶向药物设计平台,已建立起包含9个1类小分子新药的临床开发管线,涵盖下一代细胞信号抑制剂、外基因组改性剂以及细胞凋亡通路关键蛋白抑制剂。公司是全球唯一一家在细胞凋亡路径关键蛋白领域均有临床开发品种的创新公司。
- 管理团队与股权结构: 公司由杨大俊博士、王少萌博士等科学家联合创立,核心管理层拥有逾二十年的医药产业经验。截至2023年年报,创始人团队持股24.8%,武田制药持股7.7%,国投创新持股5.3%,其他股东持股62.2%。
- 重大BD交易与财务里程碑: 2022年6月,亚盛医药与武田制药达成奥雷巴替尼中国之外全球权益的合作,获得1亿美元选择权付款和7500万美元股权投资,并有望获得总额约12亿美元的里程碑付款和双位数比例的特许权使用费。此交易是国产小分子肿瘤药物出海中BD总金额最大的交易。受此推动,公司在2024年H1首次实现盈利,营业收入8.2亿元(+477%),净利润1.6亿元,货币资金余额达18亿元。公司已递表赴美上市,以拓展融资渠道。
- 国际化管线布局: 截至2024年6月30日,公司在血液瘤和实体瘤领域布局6个临床研发阶段的小分子新药。公司在全球开展40多项I/II期临床试验和8项临床注册试验,其中2项获FDA批准。公司拥有520项授权专利,其中367项为海外授权专利(70.6%),并拥有约80人的海外临床团队。
2. 核心产品商业化进展与销售预测
亚盛医药的核心产品奥雷巴替尼和Lisaftoclax正处于商业化或NDA阶段,预计到2033年将贡献176.7亿元人民币的风险调整后全球销售额。
- 奥雷巴替尼(BCR-ABL TKI):
- 市场潜力与竞争格局: 全球BCR-ABL抑制剂市场规模超60亿美元。奥雷巴替尼作为中国首个且唯一上市的第三代BCR-ABL抑制剂,已获批治疗慢性髓性白血病(CML)耐药患者。其对普纳替尼、阿思尼布等耐药患者依然有效,且安全性大幅提升,无普纳替尼的“危及生命的血栓和血管重度狭窄”风险,具备同类最佳(Best-in-class)潜力。预计2035年风险调整后海外销售峰值有望达到21.3亿美元。
- CML患者需求: CML每年全球新发患者约7万人,中国约1.7万人,美国约0.9-1万人。CML存量患者庞大,但对一代和二代TKI耐药性问题突出,特别是T315I突变,占伊马替尼、尼洛替尼、达沙替尼耐药患者的比例分别为12.3%、27.3%和34.1%,存在巨大的未满足临床需求。
- 产品优势: 奥雷巴替尼疗效更强,在普纳替尼、阿思尼布耐药患者中展现良好临床获益和耐受性,MMR率高于竞品,血液学反应显著更优(CC201研究中达到100%血液学缓解)。它能有效抑制野生型BCR-ABL及多种突变型(包括T315I),且安全性更优,动脉闭塞事件(AOEs)发生率更低(5% vs 普纳替尼15%-20%),已被纳入NCCN和CSCO指南。
- 适应症拓展: 国内已获批T315I突变CML和1代/2代TKI耐药CML-CP适应症,并已纳入医保。预计2025年1代/2代TKI耐药CML-CP适应症将进入医保,覆盖患者人数有望扩充。海外,针对2个及以上TKI耐药CML-CP的全球注册III期POLARIS-2已获FDA许可,预计2026年递交NDA。
- 其他适应症潜力: 在Ph+ ALL领域,奥雷巴替尼联合疗法(与维奈托克、贝林妥欧单抗或化疗)展现出100%的ORR率和高CMR率,有望实现“无化疗”和“无移植”疗法。全球注册III期POLARIS-1正在国内开展。在SDH缺陷型GIST中,奥雷巴替尼也显示初步疗效(ORR 23.1%,临床获益率92.3%,mPFS 22个月),全球注册III期POLARIS-3正在国内开展。
- 销售额预测: 预计2033年奥雷巴替尼国内销售额达13.7亿元(CML耐药、1L ALL、1L GIST),海外销售额达94.8亿元(CML耐药适应症,市占率12%),公司将获得15.2亿元销售分成。
- Lisaftoclax(BCL-2,APG-2575):
- 市场背景与未满足需求: 维奈克拉(全球唯一上市BCL-2抑制剂)2023年全球销售额23亿美元,但存在BCL-2基因突变导致的耐药性、肿瘤溶解综合征(TLS)风险、复杂剂量递增方案以及与BTKi的药物-药物相互作用(DDI)等问题。全球仅有2款BCL-2抑制剂进入III期临床,Lisaftoclax是其中之一。
- 产品优势: Lisaftoclax是公司自主研发的BCL-2选择性抑制剂,有望成为国内首个针对CLL/SLL递交NDA申请的BCL-2抑制剂。其疗效显著,与阿卡替尼联用治疗初治CLL/SLL患者ORR达100%,复发/难治人群ORR达97%,且无潜在DDI风险。安全性方面,未观察到TLS事件发生,中性粒细胞减少症发生比例更低(26% vs 维奈克拉联用GAZYVA的52.8%)。采用每日梯度剂量递增给药,方案简洁便利,一周内可达治疗剂量,并取消了BTK抑制剂的单药导入期。
- CLL/SLL适应症进展: 国内单药治疗R/R CLL/SLL的NDA预计2024年递交。针对一线CLL/SLL,Lisaftoclax联合阿卡替尼对照免疫化疗(FCR方案)的全球注册III期GLORA-2已获CDE批准。针对BTKi经治CLL/SLL患者,Lisaftoclax联合BTK抑制剂vs BTK抑制剂的全球注册III期GLORA已获FDA批准,展现出潜在最佳的ORR率(98%)。
- AML适应症潜力: 急性髓系白血病(AML)患者5年生存率低,老年患者预后差。Lisaftoclax联合阿扎胞苷治疗一线AML患者(n=39)ORR率64.1%,CR率51.3%,安全性可控,无TLS事件发生。全球注册III期GLORA-3已获CDE批准。
- MDS适应症突破: 骨髓增生异常综合征(MDS)中高危患者存在未满足临床需求。维奈克拉联合阿扎胞苷已获FDA突破性疗法认定。Lisaftoclax联合阿扎胞苷治疗一线中高危MDS的全球注册III期GLORA-4已获CDE批准,有望实现“从0到1”突破。
- MM适应症验证: 多发性骨髓瘤(MM)是全球第二大血液癌症,后线治疗选择有限。Lisaftoclax联合泊马度胺+地塞米松治疗R/R MM患者ORR达70.4%,联合达雷木单抗+来那度胺+地塞米松CR率达100%,安全性良好。Ib/II期临床试验正在中美进行。
- 销售额预测: 预计2033年Lisaftoclax国内销售额达5.7亿元,海外销售额达62.5亿元。
3. 其他在研管线:靶点创新性好,具备联用潜力
亚盛医药的其他在研管线也展现出良好的创新性和市场潜力。
- APG-115(MDM2-P53抑制剂): 高选择性、口服小分子MDM2抑制剂,通过恢复p53肿瘤抑制活性。已获6项FDA孤儿药资格认定(ODD)和2项FDA儿童罕见病资格认定(RPDD)。在腺样囊性癌(ACC)和恶性周围神经鞘瘤(MPNST)中展现初步疗效。与Lisaftoclax联用可同时靶向BCL-2和MCL-1,产生协同致死效应,正在进行I期研究。
- APG-1252(BCL-2/Bcl-xL双重抑制剂): 全球尚无靶向BCL-2和Bcl-xL的双重抑制剂上市。APG-1252通过差异化设计(含负电荷磷酸基团)降低血小板毒性。正在开发SCLC、NSCLC、神经内分泌瘤/非霍奇金淋巴瘤等。与奥希替尼联用对EGFR突变NSCLC患者具有良好治疗潜力,ORR率达80.8%。
- APG-2449(ALK/FAK/ROS1抑制剂): 公司自研的口服小分子ALK/FAK/ROS1三联抑制剂,是第一个国产第三代ALK抑制剂。旨在解决ALK阳性NSCLC患者对二代ALK TKI的继发耐药问题。两项针对NSCLC的III期临床研究已获CDE批准。在未经TKI治疗和二代ALK TKI耐药的NSCLC患者中显示初步疗效,并对脑转移病灶有初步抑制作用。
- APG-5918(EED抑制剂): 首个进入临床阶段的国产原研EED抑制剂,通过干扰EED识别H3K27,阻止EED和组蛋白EZH2相互作用。在血液肿瘤、实体瘤和血红蛋白病等领域具有临床应用前景。I期临床试验已在中国和美国获批并入组。
4. 盈利预测及估值
- 财务预测: 预计公司FY24-26营收分别为9.5亿元、5.7亿元和29.9亿元。对应FY24-26的净利润分别为-3.8亿元、-8.5亿元和12.4亿元。研发费用预计将持续增长,FY24-26分别为9.1亿元、9.4亿元和11.4亿元。
- 估值模型: 采用经风险调整的贴现现金流(DCF)模型,基于2024-2033财年的现金流预测。基于WACC 10.0%和永续增长率3.0%,对应目标价48.0港元/股。首次覆盖给予“优于大市”评级。
5. 风险提示
主要风险包括药品销售未及预期、新药研发风险、行业竞争加剧、汇率波动以及政策调整等。
总结
创新驱动的全球化战略与核心产品前景广阔
亚盛医药凭借其深厚的研发实力和全球化战略,正逐步从一家专注于原创新药研发的生物医药公司,成长为具有国际竞争力的全球化药企。公司在细胞凋亡通路新药研发领域的独特地位,以及由科学家主导的经验丰富的管理团队,为其持续创新提供了坚实基础。
- 核心产品市场地位与增长潜力: 奥雷巴替尼作为中国首个第三代BCR-ABL抑制剂,在CML耐药患者中展现出同类最佳的潜力,并通过适应症拓展和海外合作,预计到2033年将实现108.5亿元的全球销售额。Lisaftoclax作为全球第二款进入关键注册临床阶段的BCL-2抑制剂,在疗效、安全性和用药便利性方面均优于现有产品,有望在CLL/SLL、AML、MDS等多个适应症中率先获批,预计到2033年全球销售额将达68.2亿元。这两款核心产品共同构成了公司未来业绩增长的强大引擎。
- 财务改善与战略布局: 与武田制药的BD交易不仅为公司带来了可观的现金流,使其在2024年上半年首次实现盈利,也验证了公司核心资产的全球价值。赴美上市的计划将进一步拓宽融资渠道,为公司未来的研发投入和商业化扩张提供长期保障。同时,公司其他在研管线,如APG-115、APG-1252、APG-2449和APG-5918,均聚焦于创新靶点,具备巨大的联用潜力和市场前景,为公司提供了多元化的增长点。尽管面临药品销售、研发、竞争、汇率和政策等多重风险,但亚盛医药凭借其强大的创新能力和全球化布局,有望在未来实现持续增长和价值创造。
-

锦波生物(920982):25Q3业绩点评:核心业务增速放缓,费用高企压制短期利润
-

迈瑞医疗(300760):单三季度迎来拐点,国际市场表现亮眼
-

可孚医疗(301087):首次覆盖:单三季度高速增长,健耳听力大幅减亏
-

爱博医疗(688050):Q3利润承压,人工晶体行业影响较大
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送