-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

康希诺公司深度:十年磨剑,蓄势待发
康希诺公司深度:十年磨剑,蓄势待发
-
下载次数:
1395 次
-
发布机构:
国元证券股份有限公司
-
发布日期:
2020-03-24
-
页数:
52页
中心思想
康希诺:疫苗行业新星与技术创新驱动
康希诺生物作为中国疫苗行业的实力新秀,凭借其卓越的研发实力和四大核心技术平台(腺病毒载体疫苗技术、蛋白结构设计和重组技术、结合技术、制剂技术),在疫苗研发领域取得了显著成就。公司由跨国制药企业高管团队创立,汇集了优秀的人才队伍,研发投入持续增长,尤其在员工薪酬方面占比高达62%,体现了对人才的重视。其首个产品埃博拉疫苗Ad5-EBOV的成功研发和上市,不仅奠定了公司在腺病毒载体技术方面的坚实基础,也彰显了其完善的研发流程和严格的质量管理体系。目前,康希诺拥有丰富的在研管线,涵盖13个疾病领域的16个疫苗产品,其中多款创新疫苗已进入临床后期或上市申请阶段,预示着公司未来强大的产品商业化潜力。
市场机遇:疫情催化与政策利好下的增长潜力
当前中国疫苗市场正经历回暖期,并受到多重利好因素的驱动。全球疫苗市场规模稳定增长,创新疫苗是主要驱动力,而中国作为人口大国,疫苗市场潜力巨大,尤其在免疫规划的完善和创新疫苗的引入方面有广阔空间。2019年实施的“最严《疫苗法》”强调全过程质量监管,将促使行业向注重产品质量和创新的头部企业集中,康希诺作为技术领先者将从中受益。此外,新冠疫情的爆发极大地提升了公众对疫苗重要性的认知和需求,预计将刺激疫苗市场,特别是二类疫苗的进一步增长。康希诺在新冠疫苗研发方面处于全球领先地位,其腺病毒载体新冠疫苗Ad5-nCoV已获批进入临床试验,这一突破性进展不仅彰显了公司的技术实力,也为其未来的市场地位和盈利能力带来了巨大的想象空间。
主要内容
康希诺公司概况与核心竞争力
公司发展历程与战略布局
康希诺生物于2009年在天津成立,由海归高管团队创立,专注于高质量人用疫苗的研发、生产和商业化。公司发展历程扎实,首个产品埃博拉疫苗Ad5-EBOV已于2017年获批上市,两款流脑疫苗(MCV2、MCV4)已提交上市申请。此外,公司在13价肺炎球菌结合疫苗、全年龄段百白破疫苗等领域也有多款产品处于临床试验阶段。康希诺的研发管线丰富,涵盖肺炎、结核病、埃博拉病毒病、脑膜炎、百白破等13个疾病领域的16个在研疫苗。公司于2019年在港股上市,并于2020年1月提交科创板上市申请,旨在广纳资金,为研发和生产提供更充足的资金支持。
核心优势:人才、技术与研发能力
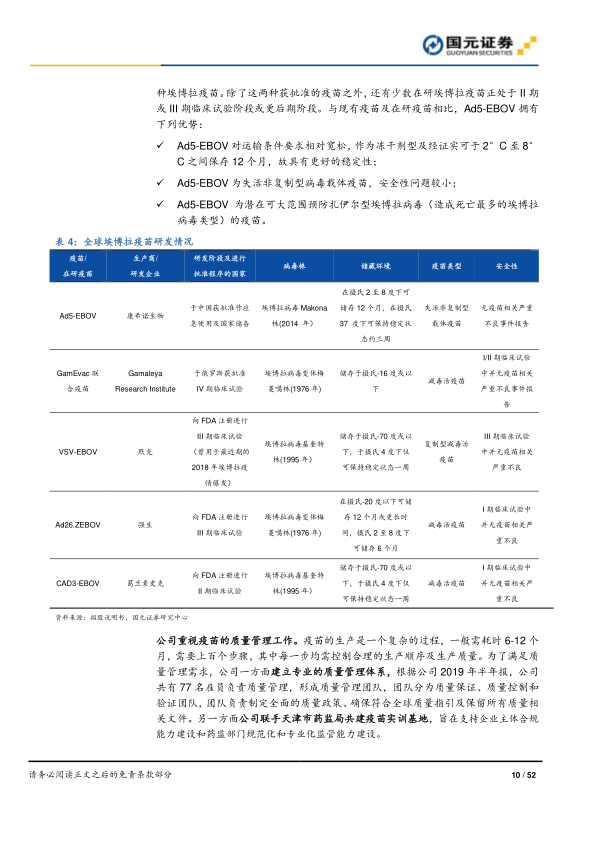
康希诺的三大核心优势是其产品研发的基石。首先,公司汇集了优秀的人才队伍,创始人团队均为疫苗研发领域的精英,拥有丰富的理论知识和技术经验。截至2019年6月30日,公司369名雇员中约78%持有学士或更高学位,研发人员在所有员工中占据主导地位。公司高度重视研发投入,2019年上半年研发开支中员工薪酬占比高达62%。其次,公司建立了四大核心技术平台:基于腺病毒载体疫苗技术(低毒性、高表达、诱导B/T细胞免疫、无需佐剂)、蛋白结构设计和重组技术(抗原设计、降低副作用、提高安全性、解决产量成本)、结合技术(多种载体蛋白抗原生产、多糖蛋白偶联、减少免疫干扰)和制剂技术(不含动物源成分、不含苯酚防腐剂、确保产品质量稳定)。这些平台相辅相成,助力创新疫苗研发,公司已获得10项发明专利。最后,公司拥有完善的研发流程,曾与军事医学科学院合作成功研制埃博拉疫苗Ad5-EBOV,该疫苗于2017年获批,作为国家安全应急储备品种,其稳定性、安全性和广谱性优于其他已批准或在研埃博拉疫苗。公司还建立了专业的质量管理体系,拥有77名雇员负责质量管理,并与天津市药监局共建疫苗实训基地,确保疫苗生产质量。
疫苗行业趋势与康希诺的战略布局
疫苗市场回暖与政策驱动
全球疫苗市场规模在2017年达到276.8亿美元,并保持稳定增长。欧美地区市场份额高,而中国市场发展潜力巨大,创新疫苗是全球市场发展的主要驱动力。中国免疫规划的全面性相对较低,疫苗种类有待更新换代,为创新疫苗提供了广阔空间。近年来,疫苗黑天鹅事件频发,促使中国政府出台了“最严《疫苗法》”,该法案于2019年12月1日实施,强调最严格的管理制度,覆盖从研发到接种的全过程监管,明确了生产准入、供应链条和接种单位资质。严格的监管将促使厂商以产品质量为重心,利好专注于产品质量与创新的公司,预计将加速行业头部效应的形成。
中国疫苗市场体量庞大,需求持续增长。尽管新生人口有所下降,但随着二胎政策等人口政策的出台,新生人口数趋于稳定,对疫苗的需求不会下降。成人疫苗市场(全球占比39%)也将成为主要增量市场。2019年中国疫苗批签发量合计5.65亿剂,同比增长5.27%,销售额在2018年约为276亿元,同比增长8.7%。消费升级和疫苗安全信心的重建将驱动二类疫苗恢复高增长。新冠疫情的爆发极大地唤起了人们对疫苗的重视,百度搜索指数显示“疫苗”关注度大幅提升,预计疫情过后将刺激疫苗需求进一步增长。
新冠疫苗研发领先与技术优势
2020年初,COVID-19疫情在全球大流行,疫苗的重要性不断提高。康希诺与军事科学院军事医学研究院生物工程研究所联合开发的重组新型冠状病毒疫苗(腺病毒载体)「Ad5-nCoV」已获批进入临床试验,研发进度全球领先。I期临床预计2020年年底结束,主要进行安全性和剂量爬坡。该疫苗基于公司成熟的腺病毒载体技术,该技术已成功应用于埃博拉疫苗Ad5-EBOV的研发,具有安全性好、可同时诱导体液免疫和细胞免疫的优势。埃博拉疫苗的临床数据显示其整体安全性和免疫原性良好,为新冠疫苗的研发提供了坚实基础。
与此同时,海外mRNA疫苗研发也进展迅速,Moderna公司的新冠疫苗已进入I期临床。mRNA技术作为药物和疫苗研发的热点,具有较好的免疫原性优势,可诱导细胞免疫反应,且不存在整合进宿主细胞的风险。然而,mRNA疫苗目前尚未有正式产品大规模商业化,其安全性和有效性仍需进一步认证。Moderna的临床设计方案对安全性观察期较长,预计完成I期临床的时间可能晚于康希诺。全球范围内还有众多医药企业和研发机构基于不同技术平台积极从事新冠疫苗的研发工作,共同推动疫苗的早日面世。
丰富管线:多款重磅疫苗蓄势待发
流脑疫苗:MCV2与MCV4双线布局
流行性脑脊髓膜炎是由脑膜炎奈瑟菌引起的全球性传染病,中国流脑疫情呈现出血清结构多元化趋势,B、W、Y群病例呈上升趋势。目前国内流脑疫苗主要有多糖疫苗和结合疫苗,结合疫苗因其更好的免疫原性和更广泛的人群适应性成为研发趋势。康希诺双线布局2价流脑结合疫苗(MCV2)和4价流脑结合疫苗(MCV4)。
4价脑膜炎球菌结合疫苗(MCV4):康希诺的MCV4适用于3月龄至6岁人群,覆盖脑膜炎球菌疾病发病率最高的婴幼儿,保护范围更广。临床试验证明其安全性及免疫原性优于国内已上市的2价结合疫苗。该产品已纳入优先审评,有望在2020年作为国内首个4价流脑结合疫苗上市,初期将独占市场。预计到2024年,4价结合疫苗年批签发量将超过700万支,为公司带来可观收入。
2价脑膜炎球菌结合疫苗(MCV2):康希诺的MCV2是潜在的中国最佳双价脑膜炎球菌疫苗,临床试验显示其在安全性及免疫原性方面优于现有产品。该产品已提交上市申请,预计2020年获批。2019年2价流脑结合疫苗批签发量约791万支,市场价值约9亿元。康希诺MCV2有望在上市后获得30%的市场份额,带来约2亿元的年收入,并有望替代2价多糖疫苗纳入计划免疫。
肺炎疫苗:PCV13与PBPV打破进口垄断
肺炎是全球儿童感染性死亡的首要原因,肺炎球菌是主要致病原。中国肺炎球菌疾病发病率较高,但接种渗透率低。康希诺针对市场需求布局了13价肺炎球菌结合疫苗(PCV13)和重组肺炎球菌蛋白疫苗(PBPV)。
13价肺炎球菌结合疫苗(PCV13i):PCV13是全球疫苗之王,辉瑞产品2018年全球销售额达58亿美元。中国市场2019年批签发量约475万支,市场份额约33亿元。康希诺的PCV13采用多糖蛋白双载体技术(CRM197与TT),旨在降低同源免疫抑制,临床前研究显示其免疫原性优于辉瑞的Prevnar 13。沃森生物的PCV13已于2019年12月获批上市,打破了辉瑞的垄断。康希诺的PCV13已于2020年1月开展I期临床试验,预计2022年完成III期临床。预计中国13价肺炎疫苗市场将超百亿,康希诺有望占据10%的市场份额,带来约10亿元的年收入。
PBPV(重组肺炎球菌蛋白疫苗):PBPV是康希诺全球创新的在研肺炎球菌疫苗,并非血清型特异性,采用肺炎球菌表面蛋白A(PspA)抗原,覆盖至少98%的肺炎球菌株,有效预防非侵入性肺炎球菌疾病。该产品初期将针对65岁以上老年人群。PBPV已于2018年10月获批临床试验,2019年开始Ia期临床,预计2020年完成。随着老年人口逐年上升,该疫苗每年或可带来3.5亿元营收(按1%渗透率,200元/支估算)。
百白破疫苗:全年龄段组合与多联苗趋势
百白破疫苗是计划免疫体系中的核心疫苗,中国接种率高达99.6%,但效果存在时效性。中国主要使用共纯化百白破(DTaP)疫苗,而发达国家以分组纯化百白破(DTcP)疫苗为主。随着消费升级和多联苗趋势,DTcP有望替代DTaP。康希诺全面布局百白破产品,包括婴幼儿用DTcP、DTcP加强疫苗和青少年及成人用Tdcp。
婴幼儿用DTcP:康希诺的婴幼儿用DTcP是潜在的中国最佳婴幼儿用百白破苗,副作用少,免疫原性好,对百日咳的保护效果优于潘太欣。公司是国内唯二获批临床试验的企业之一,已在中国开始I期临床,预计2020年内开展III期临床。
DTcP加强疫苗:该产品是中国潜在的首创DTcP加强疫苗,主要针对接种共纯化DTaP疫苗后需要加强免疫的儿童。已于2018年1月获批临床,I期临床顺利进行中,预计2020年完成。
青少年及成人用百日咳疫苗(Tdcp):Tdcp是专为青少年及成人研发的潜在全球最佳百日咳疫苗,配方和免疫原性优于Boostrix和Adacel。公司计划于2020年年底前在中国提交临床试验申请。
百白破-b型流感嗜血杆菌联合疫苗(DTcP-Hib):多联疫苗是疫苗行业发展趋势,可减少接种次数。目前国内多联苗批签发量明显上升。康希诺的DTcP-Hib联合疫苗已完成工艺研究和质量标准制定,预计2020年内提交临床申请,竞争者尚少。
结核病加强疫苗:应对卡介苗效力衰退
中国是结核病大国,2018年新增患者82.3万人,居全球第二。卡介苗接种10-20年后效力会逐渐衰退,而重复接种无法为成人提供保护。康希诺正在研发一种针对4至18岁卡介苗初免人群的全球创新结核病加强疫苗Ad5Ag85A。该疫苗在Ia期临床试验中显示出良好的安全性和耐受性,能有效提高卡介苗接种人群的免疫力。目前Ib期临床试验正在加拿大进行,预计2020年完成。中国目标人群庞大(2019年约2.2亿人),假设1%渗透率,每年可带来3.5亿元营收。
盈利预测与投资建议
康希诺目前尚未有产品商业化,预计2020年上市的两款流脑疫苗将成为公司盈利的起点。公司生产厂房年原液产能达7,000万至8,000万剂,可满足初期商业化需求。基于对流脑疫苗、13价肺炎球菌疫苗等产品的销售预测,预计到2025年公司收入将达约25亿元。若其他新疫苗成功上市或海外市场顺利开拓,实际收入可能更高。
风险提示
公司面临研发失败或研发进度不及预期、疫苗质量安全风险、疫苗黑天鹅事件、市场空间不及预期以及产品商业化不及预期等风险。
总结
康希诺生物凭借其深厚的技术积累、卓越的研发团队和完善的质量管理体系,已成为中国疫苗行业中冉冉升起的新星。公司在腺病毒载体疫苗技术等四大核心平台上的创新能力,使其在埃博拉疫苗的成功研发和新冠疫苗的全球领先进展中得到充分体现。面对中国疫苗市场在政策趋严、消费升级和疫情催化下的回暖与增长机遇,康希诺的丰富产品管线,特别是即将上市的流脑疫苗以及在研的肺炎疫苗和百白破疫苗组合,将为其带来巨大的商业化潜力。尽管面临研发和市场风险,但康希诺的创新驱动和战略布局,使其有望在未来中国乃至全球疫苗市场中占据重要地位,实现显著的盈利增长。
-

GLP-1受体激动剂行业深度报告:GLP-1RAs引领降糖减重市场,更多适应症有待开发
-

2025年半年报点评:25H1营收快速增长,投放加大致盈利短暂承压
-

医药生物行业周报:集采政策持续优化,关注相关受益板块
-

医药生物行业周报:《2025年基本医保目录及商保创新药目录调整申报操作指南》出炉,继续看好创新药
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






最新报告
对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送