-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

食管鳞癌一线获批,PD-1适应症增至五项
食管鳞癌一线获批,PD-1适应症增至五项
-
下载次数:
521 次
-
发布机构:
国金证券股份有限公司
-
发布日期:
2022-05-18
-
页数:
4页
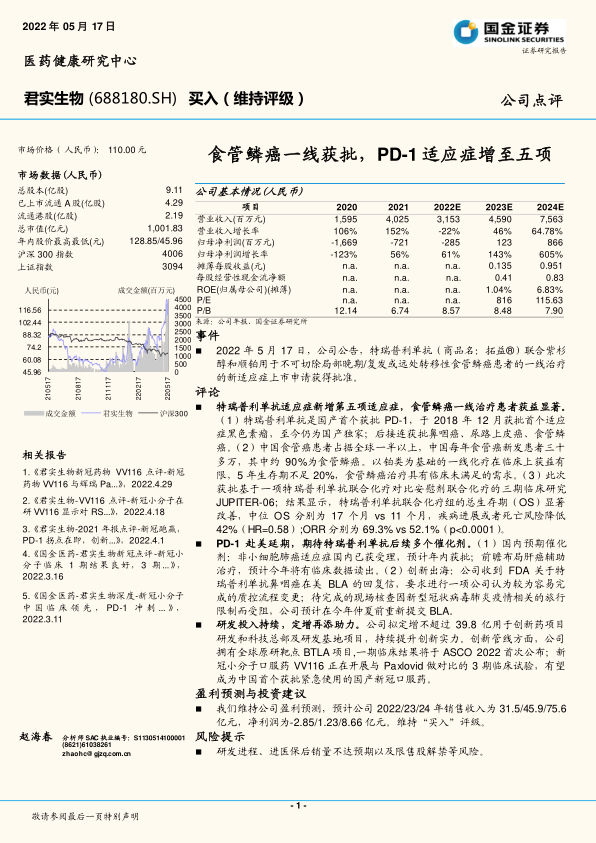
君实生物(688180)
事件
2022年5月17日,公司公告,特瑞普利单抗(商品名:拓益®)联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗的新适应症上市申请获得批准。
评论
特瑞普利单抗适应症新增第五项适应症,食管鳞癌一线治疗患者获益显著。(1)特瑞普利单抗是国产首个获批PD-1,于2018年12月获批首个适应症黑色素瘤,至今仍为国产独家;后接连获批鼻咽癌、尿路上皮癌、食管鳞癌。(2)中国食管癌患者占据全球一半以上,中国每年食管癌新发患者三十多万,其中约90%为食管鳞癌。以铂类为基础的一线化疗在临床上获益有限,5年生存期不足20%,食管鳞癌治疗具有临床未满足的需求。(3)此次获批基于一项特瑞普利单抗联合化疗对比安慰剂联合化疗的三期临床研究JUPITER-06;结果显示,特瑞普利单抗联合化疗组的总生存期(OS)显著改善,中位OS分别为17个月vs11个月,疾病进展或者死亡风险降低42%(HR=0.58);ORR分别为69.3%vs52.1%(p<0.0001)。
PD-1赴美延期,期待特瑞普利单抗后续多个催化剂。(1)国内预期催化剂:非小细胞肺癌适应症国内已获受理,预计年内获批;前瞻布局肝癌辅助治疗,预计今年将有临床数据读出。(2)创新出海:公司收到FDA关于特瑞普利单抗鼻咽癌在美BLA的回复信,要求进行一项公司认为较为容易完成的质控流程变更;待完成的现场核查因新型冠状病毒肺炎疫情相关的旅行限制而受阻,公司预计在今年仲夏前重新提交BLA。
研发投入持续,定增再添助力。公司拟定增不超过39.8亿用于创新药项目研发和科技总部及研发基地项目,持续提升创新实力。创新管线方面,公司拥有全球原研靶点BTLA项目,一期临床结果将于ASCO2022首次公布;新冠小分子口服药VV116正在开展与Paxlovid做对比的3期临床试验,有望成为中国首个获批紧急使用的国产新冠口服药。
盈利预测与投资建议
我们维持公司盈利预测,预计公司2022/23/24年销售收入为31.5/45.9/75.6亿元,净利润为-2.85/1.23/8.66亿元。维持“买入”评级。
风险提示
研发进程、进医保后销量不达预期以及限售股解禁等风险。
中心思想
核心产品适应症拓展驱动市场增长
君实生物的核心产品特瑞普利单抗(拓益®)在食管鳞癌一线治疗领域获得新适应症批准,标志着其适应症数量增至五项,显著拓宽了市场空间,尤其在中国食管癌患者基数庞大的背景下,有望满足巨大的未被满足的临床需求。此次获批基于优异的三期临床数据,进一步巩固了特瑞普利单抗的市场地位。
研发投入持续与未来业绩拐点可期
公司持续高强度投入研发,并通过定增计划进一步增强创新实力,布局了包括BTLA项目和新冠口服药VV116在内的多元化创新管线。尽管当前仍处于亏损状态,但随着特瑞普利单抗国内外市场拓展的加速以及创新管线的逐步兑现,预计公司将在2023年实现归母净利润转正,并在2024年实现显著增长,预示着业绩拐点即将到来。
主要内容
市场概况与财务预测
市场表现与估值
截至报告发布日,君实生物的市场价格为110.00元人民币,总股本9.11亿股,已上市流通A股4.29亿股,流通港股2.19亿股,总市值达1001.83亿元。公司年内股价最高达128.85元,最低为45.96元。从估值指标看,预计2023年和2024年的P/E分别为816倍和115.63倍,P/B则在8.48倍和7.90倍之间,反映市场对其未来增长的较高预期。
盈利能力与增长预期
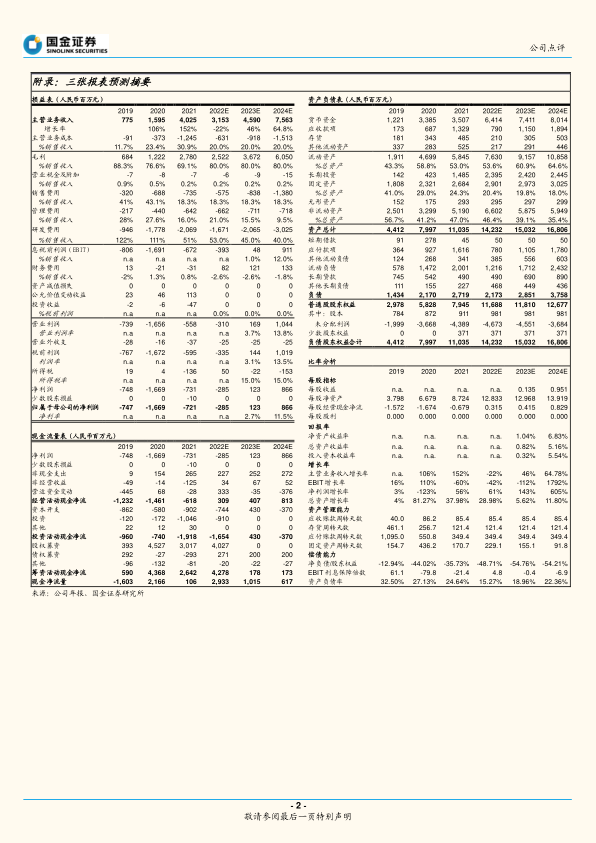
根据国金证券研究所的盈利预测,君实生物的营业收入预计将从2021年的40.25亿元在2022年小幅下降至31.53亿元(-22%),但随后将强劲反弹,2023年和2024年分别达到45.90亿元(+46%)和75.63亿元(+64.78%)。归母净利润方面,公司预计在2022年亏损收窄至-2.85亿元(亏损同比收窄61%),并在2023年实现盈利1.23亿元(同比增长143%),2024年进一步大幅增长至8.66亿元(同比增长605%),显示出显著的业绩改善趋势。摊薄每股收益预计在2023年为0.135元,2024年为0.951元。
核心产品特瑞普利单抗(拓益®)的里程碑与潜力
食管鳞癌新适应症获批及其临床意义
2022年5月17日,君实生物公告特瑞普利单抗(拓益®)联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗的新适应症上市申请获得批准。这是特瑞普利单抗获批的第五项适应症,此前已获批黑色素瘤(国产独家)、鼻咽癌和尿路上皮癌。中国食管癌患者数量占据全球一半以上,其中约90%为食管鳞癌,而传统铂类一线化疗的5年生存期不足20%,存在巨大的临床未满足需求。此次获批基于JUPITER-06三期临床研究,结果显示特瑞普利单抗联合化疗组的总生存期(OS)显著改善,中位OS分别为17个月对比11个月,疾病进展或死亡风险降低42%(HR=0.58),客观缓解率(ORR)分别为69.3%对比52.1%(p<0.0001),证明了其在食管鳞癌一线治疗中的显著临床获益。
国内外市场拓展与未来催化剂
在国内市场,特瑞普利单抗的非小细胞肺癌适应症已获受理,预计年内获批;肝癌辅助治疗的前瞻性布局也预计在今年有临床数据读出。在国际市场,公司收到了FDA关于特瑞普利单抗鼻咽癌在美国BLA的回复信,要求进行一项质控流程变更,并因疫情相关的旅行限制导致现场核查受阻,公司预计在今年仲夏前重新提交BLA,有望实现创新出海。
研发投入与创新管线布局
持续的研发投入与融资支持
君实生物持续保持高强度的研发投入,并计划通过不超过39.8亿元的定增项目,进一步支持创新药项目研发和科技总部及研发基地建设,以持续提升创新实力。公司在2021年的研发费用高达20.69亿元,占销售收入的51%,预计未来几年仍将维持在40%-53%的较高水平。
创新药与新冠口服药的战略布局
在创新管线方面,公司拥有全球原研靶点BTLA项目,其一期临床结果将于ASCO 2022首次公布。此外,公司的新冠小分子口服药VV116正在开展与辉瑞Paxlovid的对比三期临床试验,有望成为中国首个获批紧急使用的国产新冠口服药,具有巨大的市场潜力。
投资建议与风险提示
维持“买入”评级
国金证券维持对君实生物的“买入”评级,并重申了2022/23/24年的销售收入和净利润预测,认为公司在核心产品适应症拓展、创新管线布局以及未来业绩增长方面具有显著潜力。市场中相关报告评级分析也显示,君实生物在过去六个月内获得了压倒性的“买入”评级,平均评分稳定在1.00至1.19之间,表明市场对公司的投资前景普遍持乐观态度。
潜在风险因素
报告提示了多项风险,包括研发进程不及预期、产品进入医保后销量不达预期以及限售股解禁等,这些因素可能对公司的未来业绩和股价表现产生影响。
总结
君实生物凭借核心产品特瑞普利单抗在食管鳞癌一线治疗领域的新适应症获批,显著拓宽了市场空间,并展现出优异的临床数据。公司持续的研发投入和多元化的创新管线布局,包括BTLA项目和新冠口服药VV116,为其未来的增长奠定了基础。尽管短期内仍面临亏损,但预计公司将在2023年实现盈利,并在2024年实现强劲增长,业绩拐点可期。国金证券维持“买入”评级,但投资者仍需关注研发进展、市场销售及限售股解禁等潜在风险。
-

基础化工行业研究:多品种涨价,涨价/通胀后成为主线
-

基础化工行业研究:“反内卷”协同再升级,有机硅价格继续上涨
-

基础化工行业研究:双碳专题:双碳内化为新“生产要素”,供给端约束将切实落地
-

基础化工行业研究:美以袭击伊朗,全球能源化工受到冲击
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送