-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用

首个国产PD-1美国获批,药品销售高增68%
首个国产PD-1美国获批,药品销售高增68%
-
下载次数:
1628 次
-
发布机构:
国金证券股份有限公司
-
发布日期:
2023-10-29
-
页数:
4页
君实生物(688180)
经营简评
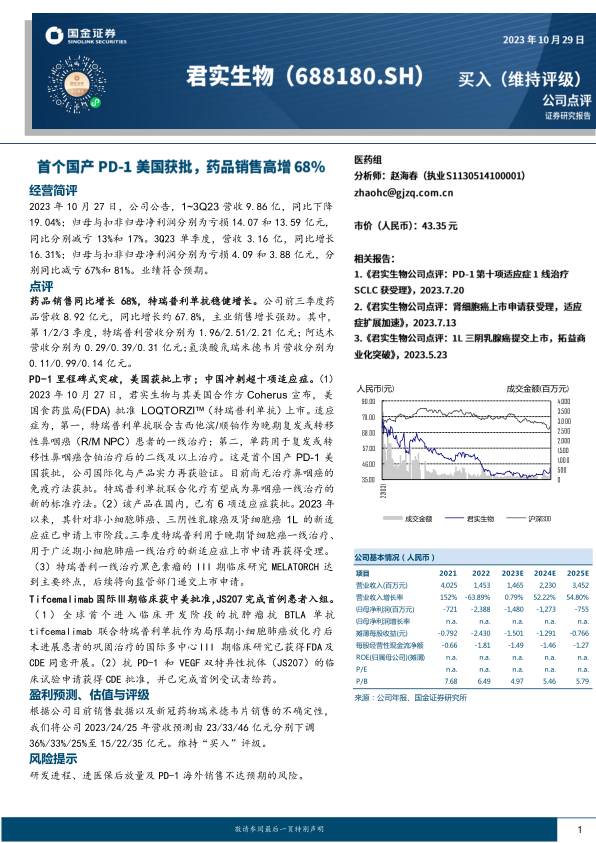
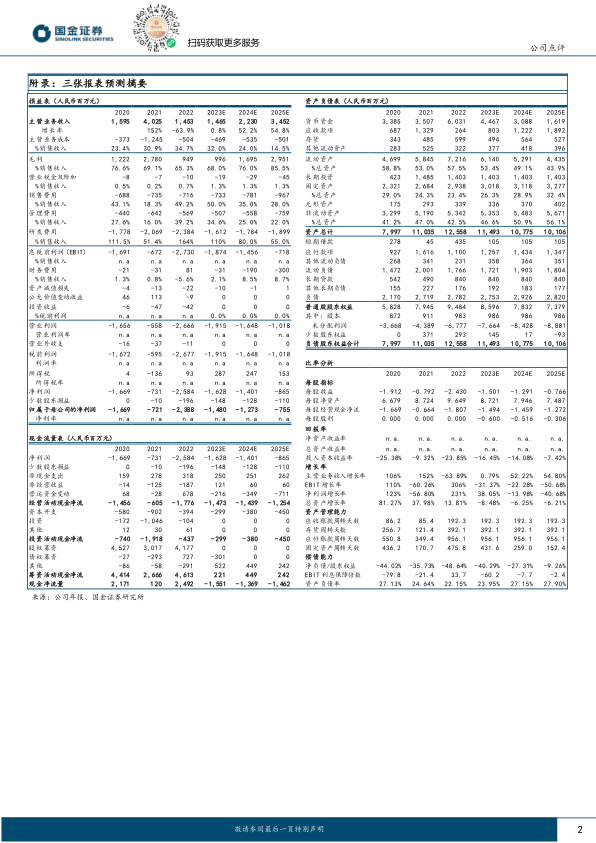
2023年10月27日,公司公告,1~3Q23营收9.86亿,同比下降19.04%;归母与扣非归母净利润分别为亏损14.07和13.59亿元,同比分别减亏13%和17%。3Q23单季度,营收3.16亿,同比增长16.31%;归母与扣非归母净利润分别为亏损4.09和3.88亿元,分别同比减亏67%和81%。业绩符合预期。
点评
药品销售同比增长68%,特瑞普利单抗稳健增长。公司前三季度药品营收8.92亿元,同比增长约67.8%,主业销售增长强劲。其中,第1/2/3季度,特瑞普利营收分别为1.96/2.51/2.21亿元;阿达木营收分别为0.29/0.39/0.31亿元;氢溴酸氘瑞米德韦片营收分别为0.11/0.99/0.14亿元。
PD-1里程碑式突破,美国获批上市;中国冲刺超十项适应症。(1)2023年10月27日,君实生物与其美国合作方Coherus宣布,美国食药监局(FDA)批准LOQTORZI™(特瑞普利单抗)上市。适应症为,第一,特瑞普利单抗联合吉西他滨/顺铂作为晚期复发或转移性鼻咽癌(R/MNPC)患者的一线治疗;第二,单药用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗。这是首个国产PD-1美国获批,公司国际化与产品实力再获验证。目前尚无治疗鼻咽癌的免疫疗法获批。特瑞普利单抗联合化疗有望成为鼻咽癌一线治疗的新的标准疗法。(2)该产品在国内,已有6项适应症获批。2023年以来,其针对非小细胞肺癌、三阴性乳腺癌及肾细胞癌1L的新适应症已申请上市阶段。三季度特瑞普利用于晚期肾细胞癌一线治疗、用于广泛期小细胞肺癌一线治疗的新适应症上市申请再获得受理。(3)特瑞普利一线治疗黑色素瘤的III期临床研究MELATORCH达到主要终点,后续将向监管部门递交上市申请。
Tifcemalimab国际Ⅲ期临床获中美批准,JS207完成首例患者入组。(1)全球首个进入临床开发阶段的抗肿瘤抗BTLA单抗tifcemalimab联合特瑞普利单抗作为局限期小细胞肺癌放化疗后未进展患者的巩固治疗的国际多中心III期临床研究已获得FDA及CDE同意开展。(2)抗PD-1和VEGF双特异性抗体(JS207)的临床试验申请获得CDE批准,并已完成首例受试者给药。
盈利预测、估值与评级
根据公司目前销售数据以及新冠药物瑞米德韦片销售的不确定性,我们将公司2023/24/25年营收预测由23/33/46亿元分别下调36%/33%/25%至15/22/35亿元。维持“买入”评级。
风险提示
研发进程、进医保后放量及PD-1海外销售不达预期的风险。
中心思想
本报告的核心在于分析君实生物2023年前三季度的经营状况,并展望未来发展。
业绩与增长分析
- 业绩表现: 报告期内,公司营收同比下降,但净利润亏损同比收窄,显示出一定的经营改善。
- 核心产品驱动: 药品销售收入显著增长,尤其是特瑞普利单抗的稳健增长,是公司业绩的重要支撑。
产品与市场前景
- 国际市场突破: 特瑞普利单抗在美国获批上市,是公司国际化进程中的里程碑事件,验证了产品实力。
- 国内市场拓展: 公司积极推进特瑞普利单抗在国内的新适应症上市,有望进一步扩大市场份额。
主要内容
公司经营概况
- 营收与利润: 1~3Q23 营收 9.86 亿,同比下降 19.04%;归母与扣非归母净利润分别为亏损14.07 和 13.59 亿元,同比分别减亏 13%和 17%。3Q23 单季度,营收 3.16 亿,同比增长 16.31%;归母与扣非归母净利润分别为亏损4.09 和 3.88 亿元,分别同比减亏67%和 81%。
- 药品销售收入: 前三季度药品营收8.92 亿元,同比增长约67.8%,主业销售增长强劲。
特瑞普利单抗的市场进展
- 美国获批上市: 君实生物与其美国合作方Coherus 宣布,特瑞普利单抗获得美国FDA批准上市,用于治疗晚期复发或转移性鼻咽癌。
- 国内适应症拓展: 国内已有6 项适应症获批,并积极申请非小细胞肺癌、三阴性乳腺癌及肾细胞癌等新适应症的上市。
其他研发项目进展
- Tifcemalimab国际Ⅲ期临床: 全球首个进入临床开发阶段的抗肿瘤抗 BTLA 单抗 tifcemalimab 联合特瑞普利单抗的国际多中心III 期临床研究已获得FDA及CDE同意开展。
- JS207临床试验: 抗 PD-1 和 VEGF 双特异性抗体(JS207)的临床试验申请获得CDE 批准,并已完成首例受试者给药。
盈利预测、估值与评级
- 营收预测调整: 根据公司目前销售数据以及新冠药物瑞米德韦片销售的不确定性,将公司2023/24/25 年营收预测下调。
- 维持“买入”评级: 维持“买入”评级。
总结
本报告对君实生物的经营状况进行了全面分析,认为公司在药品销售方面表现强劲,特瑞普利单抗的国内外市场进展显著。尽管面临新冠药物销售不确定性带来的营收预测下调,但公司在研管线的积极进展和国际化突破,仍然值得期待。维持“买入”评级,但需关注研发进程、进医保后放量及PD-1海外销售不达预期的风险。
-

基础化工行业研究:多品种涨价,涨价/通胀后成为主线
-

基础化工行业研究:“反内卷”协同再升级,有机硅价格继续上涨
-

基础化工行业研究:双碳专题:双碳内化为新“生产要素”,供给端约束将切实落地
-

基础化工行业研究:美以袭击伊朗,全球能源化工受到冲击
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案






对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送