-
{{ listItem.name }}快速筛选药品,用摩熵药筛
 微信扫一扫-立即使用
微信扫一扫-立即使用
立即咨询
产品矩阵


摩熵数科产品矩阵
查看详情
{{ item.category }}
{{ product.info.desc }}

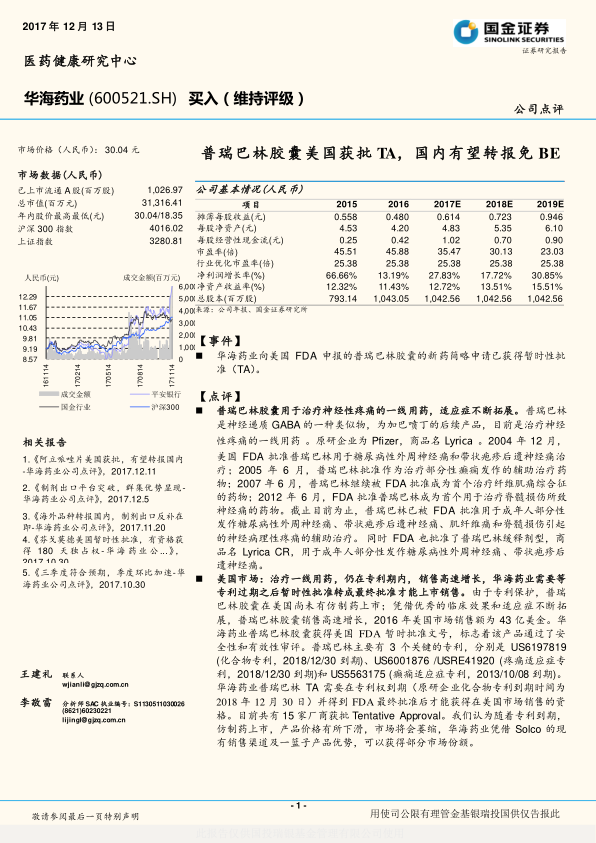
普瑞巴林胶囊美国获批TA,国内有望转报免BE
研报
普瑞巴林胶囊美国获批TA,国内有望转报免BE
# 中心思想
本报告的核心观点如下:
* **普瑞巴林市场潜力分析:** 华海药业的普瑞巴林胶囊在美国获得暂时性批准,预示着其在该药物市场具有增长潜力。报告分析了普瑞巴林的市场现状、竞争格局以及华海药业的潜在优势。
* **制剂出口与国内市场双驱动:** 华海药业通过制剂出口积累了经验,并积极转报国内市场。报告强调了“优先审评审批”和“等同于通过一致性评价”等政策优势,以及公司在国内市场的长期发展潜力。
# 主要内容
## 事件
* 华海药业向美国FDA申报的普瑞巴林胶囊的新药简略申请已获得暂时性批准(TA)。
## 点评
### 普瑞巴林胶囊:神经性疼痛一线用药,适应症不断拓展
* 普瑞巴林是神经递质GABA的一种类似物,为加巴喷丁的后续产品,目前是治疗神经性疼痛的一线用药。
* 原研企业为Pfizer,商品名Lyrica。
* 适应症包括糖尿病性外周神经痛、带状疱疹后遗神经痛、部分性癫痫发作的辅助治疗、纤维肌痛综合征、脊髓损伤所致神经痛等。
### 美国市场:专利期内销售高速增长,华海药业有望分羹市场
* 普瑞巴林胶囊在美国尚未有仿制药上市,2016年美国市场销售额为43亿美金。
* 华海药业普瑞巴林胶囊获得美国FDA暂时批准文号,标志着该产品通过了安全性和有效性审评。
* 普瑞巴林主要有3个关键的专利,分别是US6197819 (化合物专利,2018/12/30到期)、US6001876 /USRE41920 (疼痛适应症专利,2018/12/30到期)和US5563175 (癫痫适应症专利,2013/10/08到期)。
* 华海药业普瑞巴林TA需要在专利权到期(原研企业化合物专利到期时间为2018年12月30日)并得到FDA最终批准后才能获得在美国市场销售的资格。
* 目前共有15家厂商获批Tentative Approval。
* 随着专利到期,仿制药上市,产品价格有所下滑,市场将会萎缩,华海药业凭借Solco的现有销售渠道及一篮子产品优势,可以获得部分市场份额。
### 国内市场:增长迅速,华海药业有望凭借优势抢占市场份额
* 目前国内普瑞巴林胶囊仅有原研Pfizer和重庆赛维药业上市,批准适应症为疱疹后神经痛。2017年进入国家医保乙类。
* 根据终端数据,普瑞巴林胶囊销售额从2011年的0.26亿人民币增长到2016年的1.74亿人民币,CAGR为37.40%。
* 从竞争格局来看,目前国内主要以Pfizer为主,但是重庆赛维从2014年开始市场占有率不断提高,截止2017年三季度,重庆赛维占据不到30%的市场份额,Pfizer超过70%。
* 随着疱疹后神经痛就诊率的提高以及新进入2017年国家医保,品种将保持高速增长。
### 制剂出口转报国内:加速上市,抢占市场先机
* 从BCS分类来看,普瑞巴林胶囊是BCS I类,在仿制药申请过程中可以免除BE;如果美国现场检查完成之后,华海药业利用普瑞巴林胶囊海外数据转报国内一方面可以享受优先审评审批,另外一方面可以以BCS I类免除临床BE,以更短的时间上市。
* 普瑞巴林胶囊上市之后,华海药业凭借在精神产品线建立的强大销售队伍,有望获得可观市场份额。
### 投资逻辑
* **制剂出口:** 十年投入成功创造“华海模式”。拥有成熟的高技术固体制剂仿制药研发、申报注册平台,现有产品集群已经形成,Solco销售平台产品已经进入美国主流销售渠道,并且在多奈哌齐、缬沙坦等品种形成竞争优势。公司后续申报产品多以缓控释等高毛利产品为主,并且专利挑战进入常态化,公司业务有望通过专利挑战成功实现质变。同时,公司通过“制剂出口平台”与国内企业合作产品在美国注册销售,打造中国制造叠加美国渠道的双赢模式。
* **国内制剂:** “优先审评审批”+“等同于通过一致性评价”+“招标优势”国内逻辑完全打通,静待产品批量上市。公司通过合作销售、自建销售团队等不同模式加速推广优势产品。长期来看,随着医保支付价、两票制等政策的执行,医药由以前的“市场销售”导向型进入以“研发、产品”为主的阶段,而华海药业完全符合该趋势的发展。
* **原料药:** 公司的业务的基石,新品种和产能释放保证稳定增长,带来持续现金流,保证公司的产品质量、成本优势和供应链的稳定。
* **生物药:** 高仿产品,目前临床中,以biosimilar优势节省注册时间和临床费用,其中针对TNFα的biosimilar进展较快,并有生物创新药在研。
### 投资建议
* 我们预计公司17-19年净利润分别为6.40/7.54/9.86亿。如果未来更多品种进入优先审评并且产品获批,将增厚公司业绩,我们将根据后续的获批时间、销售情况再进行调整。综合考虑到公司制剂出口的龙头地位,在国内制剂业务的巨大潜力及单抗业务的长期布局,给予“买入”评级。
### 风险提示
* ANDA获批不达预期:FDA在GDUFA法案之后整体的药品审批的速度加速,但是由于还存在部分品种的积压,对于不是特别短缺的品种,FDA的审批有可能低于预期。
* 国内审批慢于预期:目前国内对于海外上市产品转报国内的数据认可和审批流程已经明确,但是CFDA目前人力不足,尤其是对于海外飞行检查的审评员不足,有可能审批低于预期。
* 销售慢于预期:公司已经搭建了300人的销售队伍,但是整体来看最近一轮招标已经完成,新的药品定价和准入体系尚未形成,尤其是医院“一品双规”等政策的限制,公司的产品上市后的销售有可能低于预期。
* 环保风险:目前国内整体的环保标准提高,华海药业从2014年开始加大环保的投入,环保标准提高,但是随着环保标准提高和检查的从严,有可能存在环保风险。
# 总结
本报告分析了华海药业普瑞巴林胶囊在美国获批的事件,并深入探讨了其在美国和中国市场的潜力。报告强调了华海药业在制剂出口方面的优势,以及通过“优先审评审批”等政策在国内市场的发展机遇。同时,报告也指出了ANDA获批、国内审批、销售以及环保等方面的风险。总体而言,报告认为华海药业凭借其在制剂出口和国内市场的双重驱动,以及原料药和生物药的布局,具有良好的发展前景,并给予“买入”评级。
报告专题:
-
下载次数:
883 次
-
发布机构:
国金证券股份有限公司
-
发布日期:
2017-12-13
-
页数:
10页
下载全文
定制咨询
AI精读报告
中心思想
本报告的核心观点如下:
- 普瑞巴林市场潜力分析: 华海药业的普瑞巴林胶囊在美国获得暂时性批准,预示着其在该药物市场具有增长潜力。报告分析了普瑞巴林的市场现状、竞争格局以及华海药业的潜在优势。
- 制剂出口与国内市场双驱动: 华海药业通过制剂出口积累了经验,并积极转报国内市场。报告强调了“优先审评审批”和“等同于通过一致性评价”等政策优势,以及公司在国内市场的长期发展潜力。
主要内容
事件
- 华海药业向美国FDA申报的普瑞巴林胶囊的新药简略申请已获得暂时性批准(TA)。
点评
普瑞巴林胶囊:神经性疼痛一线用药,适应症不断拓展
- 普瑞巴林是神经递质GABA的一种类似物,为加巴喷丁的后续产品,目前是治疗神经性疼痛的一线用药。
- 原研企业为Pfizer,商品名Lyrica。
- 适应症包括糖尿病性外周神经痛、带状疱疹后遗神经痛、部分性癫痫发作的辅助治疗、纤维肌痛综合征、脊髓损伤所致神经痛等。
美国市场:专利期内销售高速增长,华海药业有望分羹市场
- 普瑞巴林胶囊在美国尚未有仿制药上市,2016年美国市场销售额为43亿美金。
- 华海药业普瑞巴林胶囊获得美国FDA暂时批准文号,标志着该产品通过了安全性和有效性审评。
- 普瑞巴林主要有3个关键的专利,分别是US6197819 (化合物专利,2018/12/30到期)、US6001876 /USRE41920 (疼痛适应症专利,2018/12/30到期)和US5563175 (癫痫适应症专利,2013/10/08到期)。
- 华海药业普瑞巴林TA需要在专利权到期(原研企业化合物专利到期时间为2018年12月30日)并得到FDA最终批准后才能获得在美国市场销售的资格。
- 目前共有15家厂商获批Tentative Approval。
- 随着专利到期,仿制药上市,产品价格有所下滑,市场将会萎缩,华海药业凭借Solco的现有销售渠道及一篮子产品优势,可以获得部分市场份额。
国内市场:增长迅速,华海药业有望凭借优势抢占市场份额
- 目前国内普瑞巴林胶囊仅有原研Pfizer和重庆赛维药业上市,批准适应症为疱疹后神经痛。2017年进入国家医保乙类。
- 根据终端数据,普瑞巴林胶囊销售额从2011年的0.26亿人民币增长到2016年的1.74亿人民币,CAGR为37.40%。
- 从竞争格局来看,目前国内主要以Pfizer为主,但是重庆赛维从2014年开始市场占有率不断提高,截止2017年三季度,重庆赛维占据不到30%的市场份额,Pfizer超过70%。
- 随着疱疹后神经痛就诊率的提高以及新进入2017年国家医保,品种将保持高速增长。
制剂出口转报国内:加速上市,抢占市场先机
- 从BCS分类来看,普瑞巴林胶囊是BCS I类,在仿制药申请过程中可以免除BE;如果美国现场检查完成之后,华海药业利用普瑞巴林胶囊海外数据转报国内一方面可以享受优先审评审批,另外一方面可以以BCS I类免除临床BE,以更短的时间上市。
- 普瑞巴林胶囊上市之后,华海药业凭借在精神产品线建立的强大销售队伍,有望获得可观市场份额。
投资逻辑
- 制剂出口: 十年投入成功创造“华海模式”。拥有成熟的高技术固体制剂仿制药研发、申报注册平台,现有产品集群已经形成,Solco销售平台产品已经进入美国主流销售渠道,并且在多奈哌齐、缬沙坦等品种形成竞争优势。公司后续申报产品多以缓控释等高毛利产品为主,并且专利挑战进入常态化,公司业务有望通过专利挑战成功实现质变。同时,公司通过“制剂出口平台”与国内企业合作产品在美国注册销售,打造中国制造叠加美国渠道的双赢模式。
- 国内制剂: “优先审评审批”+“等同于通过一致性评价”+“招标优势”国内逻辑完全打通,静待产品批量上市。公司通过合作销售、自建销售团队等不同模式加速推广优势产品。长期来看,随着医保支付价、两票制等政策的执行,医药由以前的“市场销售”导向型进入以“研发、产品”为主的阶段,而华海药业完全符合该趋势的发展。
- 原料药: 公司的业务的基石,新品种和产能释放保证稳定增长,带来持续现金流,保证公司的产品质量、成本优势和供应链的稳定。
- 生物药: 高仿产品,目前临床中,以biosimilar优势节省注册时间和临床费用,其中针对TNFα的biosimilar进展较快,并有生物创新药在研。
投资建议
- 我们预计公司17-19年净利润分别为6.40/7.54/9.86亿。如果未来更多品种进入优先审评并且产品获批,将增厚公司业绩,我们将根据后续的获批时间、销售情况再进行调整。综合考虑到公司制剂出口的龙头地位,在国内制剂业务的巨大潜力及单抗业务的长期布局,给予“买入”评级。
风险提示
- ANDA获批不达预期:FDA在GDUFA法案之后整体的药品审批的速度加速,但是由于还存在部分品种的积压,对于不是特别短缺的品种,FDA的审批有可能低于预期。
- 国内审批慢于预期:目前国内对于海外上市产品转报国内的数据认可和审批流程已经明确,但是CFDA目前人力不足,尤其是对于海外飞行检查的审评员不足,有可能审批低于预期。
- 销售慢于预期:公司已经搭建了300人的销售队伍,但是整体来看最近一轮招标已经完成,新的药品定价和准入体系尚未形成,尤其是医院“一品双规”等政策的限制,公司的产品上市后的销售有可能低于预期。
- 环保风险:目前国内整体的环保标准提高,华海药业从2014年开始加大环保的投入,环保标准提高,但是随着环保标准提高和检查的从严,有可能存在环保风险。
总结
本报告分析了华海药业普瑞巴林胶囊在美国获批的事件,并深入探讨了其在美国和中国市场的潜力。报告强调了华海药业在制剂出口方面的优势,以及通过“优先审评审批”等政策在国内市场的发展机遇。同时,报告也指出了ANDA获批、国内审批、销售以及环保等方面的风险。总体而言,报告认为华海药业凭借其在制剂出口和国内市场的双重驱动,以及原料药和生物药的布局,具有良好的发展前景,并给予“买入”评级。
如果您有其他需求,请点击
定制服务咨询
国金证券股份有限公司最新报告
-

基础化工行业研究:多品种涨价,涨价/通胀后成为主线
-

基础化工行业研究:美以袭击伊朗,全球能源化工受到冲击
-

医药健康行业研究:创新器械进入加速新阶段,看好国产龙头发展机遇
-

汇率波动影响短期业绩,长期增长动力充足
关于摩熵咨询
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案
1W+
医药行业研究报告
200+
真实项目案例
1300+
业内高端专家资源

市场洞察与营销赋能
分析市场现状,洞察行业趋势,依托数据分析和深度研究,辅助商业决策。

立项评估及管线规划
提供疾病领域品种调研、专家访谈、品种立项、项目交易整套服务。

产业规划及研究服务
以数据为基础,为组织、园区、企业提供科学的决策依据和趋势线索。

多渠道数据分析及定制服务
帮助客户深入了解目标领域和市场情况,发现潜在机会,优化企业决策。

投资决策与交易估值
依托全球医药全产业链数据库与顶级投行级分析模型,为并购、融资、IPO提供全周期决策支持。

立即定制
最新报告
- 基础化工行业研究:多品种涨价,涨价/通胀后成为主线
- 氟化工行业周报:三代制冷剂报价全面上调,氟材料底部复苏迹象明显,四氯乙烯价格大幅上涨
- 医药日报:Zongertinib获FDA加速批准
- 医药行业周报:医药供给端变量增加
- 医药行业周报:创新药板块利好频现、Q2多项大会值得期待,持续关注创新药、脑机接口、AI医疗
- 公司信息更新报告:2025年业绩表现亮眼,经营态势稳步向好
- 基础化工行业周报:节后化纤价格普遍上涨,看好磷化工战略价值重估
- 化工行业周报:国际油价上涨,TDI、黄磷价格上涨
- 基础化工行业研究:美以袭击伊朗,全球能源化工受到冲击
- 医药健康行业研究:创新器械进入加速新阶段,看好国产龙头发展机遇
对不起!您还未登录!请登陆后查看!
立即登录
您今日剩余【10】次下载额度,确定继续吗?
取消
确定
确定
获取定制报告
请填写你的需求,我们将尽快与您取得联系
姓名
{{nameTip}}
单位
{{companyTip}}
电话
{{telTip}}
验证码
{{sms_codeTip}}
{{ setTime ? `${second}s` : '获取验证码' }}
邮箱
{{emailTip}}
需求描述
{{descriptionTip}}
提交
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送