
一、本周国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
1.1总体概况
根据摩熵数据统计,2025.01.06-2025.01.12期间共有96个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中国产药品受理号86个,进口药品受理号10个。
本周共计73款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药38款,生物药30款,中药5款。其中值得注意的有:
(1)MRX-5片
1月6日,CDE官网公示:诺华(Novartis)的MRX-5片获得临床试验默示许可,用于治疗复发性和/或难治性B细胞恶性肿瘤。公开资料显示,MRX-5片是一款潜在“first-in-class”抗CD3/CD19/CD2的三特异性抗体。它可以靶向恶性B细胞上的CD19,同时可与T细胞上的CD3(TCR信号传导成分)和CD2(一种共刺激受体)结合,导致T细胞对CD19阳性恶性B细胞产生重定向的细胞毒性。与CD3双特异性相比,通过PIT565共刺激CD2可能会克服T细胞衰竭,增加患者反应的深度和持续时间。
(2)ADI-001
1月10日,CDE官网公示:Adicet Bio的ADI-001获得临床试验默示许可,用于治疗自身免疫性疾病。公开资料显示,ADI-001是是一种即用型CD20靶向CARγδ-T细胞疗法,与其它类型的T细胞不同,γδ-T细胞不需要与主要组织相容性复合物(MHC)分子结合,可以直接识别并结合靶细胞抗原,这一特性意味着γδ-T细胞不太可能受到治疗耐药性的影响,从而针对肿瘤细胞产生强大的杀伤作用。
(3)HM-2002注射液
1月10日,CDE官网公示:环码生物的HM-2002注射液获得临床试验默示许可,用于治疗缺血性心脏病。公开资料显示,HM-2002注射液是环码生物依托其自主创新技术平台研发的新一代环形RNA候选药物,其通过在心肌内稳定表达血管内皮生长因子(VEGF),有效促进血管新生与心肌灌注,加速心功能恢复,相比传统线性RNA,环形RNA技术使它稳定性更强、免疫原性更低,具有独特优势。
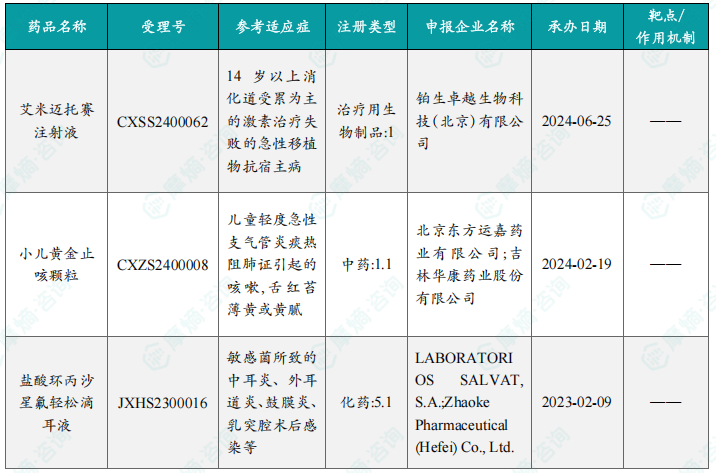
本周共3款新药获批上市,即艾米迈托赛注射液、小儿黄金止咳颗粒和盐酸环丙沙星氟轻松滴耳液。
中心思想
本报告基于摩熵咨询医药行业观察周报(2025.01.06-2025.01.12)的数据,对国内外医药市场创新药、仿制药及相关政策法规进行分析。核心观点如下:
国内创新药研发加速,临床获批数量显著
国内创新药研发持续活跃,本周CDE承办的创新药/改良型新药临床/上市申请数量达96个,其中73款获得临床试验默示许可,涵盖化学药、生物药和中药多个领域。值得关注的是几款具有潜在“first-in-class”潜力的创新药物,例如诺华的MRX-5片(三特异性抗体)、Adicet Bio的ADI-001(CD20靶向CAR γδ-T细胞疗法)和环码生物的HM-2002注射液(环形RNA候选药物)。此外,本周还有3款创新药获批上市,涉及治疗急性移植物抗宿主病、中耳炎等领域。
国内仿制药一致性评价进展迅速,市场竞争加剧
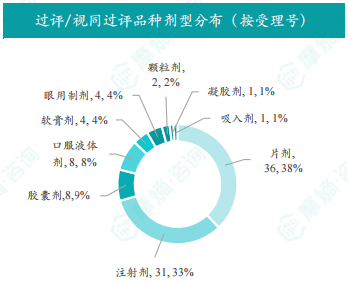
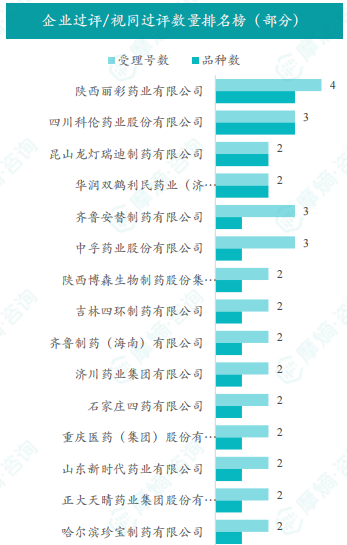
国内仿制药市场竞争日益激烈,本周共有241项仿制药申报上市/申报临床获CDE承办,其中16个品种通过一致性评价,50个品种视同通过一致性评价。通过/视同通过一致性评价的品种主要为系统用抗感染药物,剂型以片剂为主。多个品种过评/视同过评企业数达2家以上,显示出市场竞争的加剧。
主要内容
本报告根据摩熵咨询医药行业观察周报的目录结构,对主要内容进行数据分析和解读。
国内创新药/改良型新药研发动态分析
本部分详细分析了本周国内创新药/改良型新药的临床申请、获批临床和上市情况。
临床申请及获批情况
数据显示,本周共有96个创新药/改良型新药临床申请/上市申请获CDE承办,其中国产药品86个,进口药品10个。73款创新药/改良型新药临床试验申请获得“默示许可”,涵盖化学药、生物药和中药。报告重点介绍了部分具有代表性的创新药物,并对其作用机制和潜在市场进行了简要分析。
上市获批情况
本周共有3款新药获批上市,分别为艾米迈托赛注射液(治疗急性移植物抗宿主病)、小儿黄金止咳颗粒(治疗儿童轻度急性支气管炎)和盐酸环丙沙星氟轻松滴耳液(治疗中耳炎等)。这些获批上市的药物为相关疾病的治疗提供了新的选择。
国内仿制药/生物类似物申报/审批数据分析
本部分对本周国内仿制药/生物类似物申报和审批情况进行了统计分析。
申报及审批概况
本周共有241项仿制药申报上市/申报临床获CDE承办,包括新注册分类上市申请和临床申请以及一致性评价申请。其中,通过/视同通过一致性评价的品种数量较多,体现了一致性评价工作的推进速度。
一致性评价进展分析
报告对本周通过/视同通过一致性评价的品种进行了详细分析,包括治疗领域分布、剂型分布以及企业排名等。数据显示,系统用抗感染药物是过评/视同过评品种的主要类型,片剂是主要的剂型。部分企业过评/视同过评品种数量较多,反映了这些企业在仿制药研发和一致性评价方面较强的实力。报告还特别列出了本周首次过评/视同过评品种和过评/视同过评达5家以上企业的品种,以突出重点。
国内医药大健康行业政策法规解读
本部分对本周发布的国内医药大健康行业政策法规进行了汇总和解读。
政策法规速览
本周发布的政策法规涵盖仿制药参比制剂目录、新型抗肿瘤药物临床应用指导原则、医疗器械产品注册审批等多个方面。
重点政策解读
报告重点解读了《新型抗肿瘤药物临床应用指导原则(2024年版)》和《国家卫生健康委主责国家重点研发计划重点专项管理实施细则》。前者旨在规范新型抗肿瘤药物临床应用,提高治疗效果,减少风险;后者则规范国家重点研发计划重点专项管理,提高研发效率和资金使用效益。
全球创新药研发进展概述
本部分对本周全球创新药研发进展进行了概述,重点介绍了TOP10创新药研发进展和TOP10积极/失败临床结果。
创新药研发进展
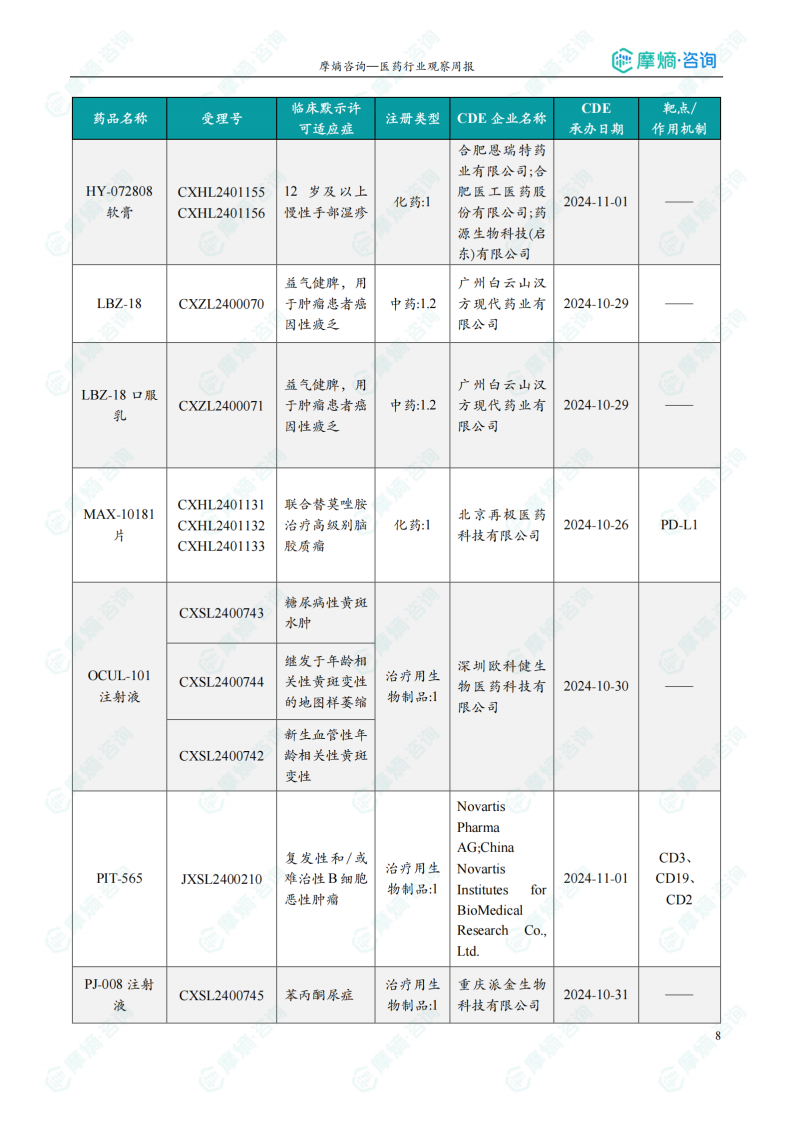
报告列举了本周全球范围内多个创新药的研发进展,包括获批临床、申报上市和获批上市等,涵盖了肿瘤、糖尿病、高胆固醇血症等多个治疗领域。
临床试验结果
报告总结了本周全球范围内多个创新药临床试验的积极和失败结果,并对这些结果进行了简要分析。这些结果为创新药的研发提供了重要的参考信息。
总结
本报告基于摩熵咨询医药行业观察周报的数据,对国内外医药市场进行了全面的分析。国内创新药研发持续活跃,临床获批数量显著;国内仿制药一致性评价进展迅速,市场竞争加剧;同时,相关政策法规的出台也为医药行业发展提供了方向指引。全球创新药研发方面,多个创新药物取得积极的临床试验结果,为相关疾病的治疗带来了新的希望。 本报告的数据分析为医药企业和投资者提供了重要的市场信息和决策参考。 需要注意的是,报告中部分数据基于摩熵数据库,更详细的数据和分析可通过摩熵数据库或联系摩熵客服获取。









-
 专利即将到期五大重磅小分子药品,国内仿制药“战况”几何?
专利即将到期五大重磅小分子药品,国内仿制药“战况”几何? -
 克氏锥虫感染临床研究进展及发展趋势报告
克氏锥虫感染临床研究进展及发展趋势报告 -
 胆管癌临床研究进展及发展趋势报告
胆管癌临床研究进展及发展趋势报告 -
 肝肾综合征临床研究进展及发展趋势报告
肝肾综合征临床研究进展及发展趋势报告
摩熵咨询是摩熵数科旗下生物医药专业咨询服务品牌,由深耕医药领域多年的专业人士组成,核心成员均来自国际顶级咨询机构和行业标杆企业,涵盖立项、市场、战略、投资等从业背景,依托摩熵数科丰富的外部专家资源及全面的医药全产业链数据库,为客户提供专业咨询服务和定制化解决方案





对不起!您还未登录!请登陆后查看!
您今日剩余【10】次下载额度,确定继续吗?
请填写你的需求,我们将尽快与您取得联系
{{nameTip}}
{{companyTip}}
{{telTip}}
{{sms_codeTip}}
{{emailTip}}
{{descriptionTip}}
*请放心填写您的个人信息,该信息仅用于“摩熵咨询报告”的发送






